Prantsuse keemik Joseph Louis Proust (1754-1826) asus läbi viima hoolikaid katseid, mis olid seotud teatud reaktsioonide komponentide massidega.
Näiteks on vee moodustavad elemendid vesinik ja hapnik. Proust leidis, et selles vett moodustavas reaktsioonis reageeris vesinik alati hapnikuga püsivas ja kindlas vahekorras, mis oli vastavalt 1: 8. Kuidas see juhtub, vaadake allpool:

Märka seda olenemata kasutatud elementide massist, on osakaal alati sama.
Proust märkis, et see pole nii ainult vee, vaid kõigi teiste ainete puhul.
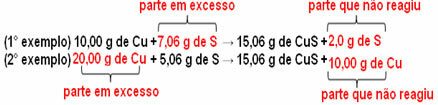
15,06 g vasesulfiidi (CuS) moodustatakse näiteks 10,00 g metallvase (Cu) reageerimisel 5,06 g väävliga (S). Niisiis, kui kahekordistame vasekoguse (mis ulatub 20,0 g-ni) ja kui tahame, et kogu vask reageeriks, samuti on vaja kahekordistada väävli kogus 10,12 g-ni, moodustades kokku 30,12 g väävlit sulfiid.
Kui nüüd lisatakse summa, mis pole proportsioonis, jääb üleliigne summa üle, siis see ei reageeri. Pange tähele seda allpool:
Ärge lõpetage kohe... Peale reklaami on veel;)
Märka seda reaktsioon toimub ainult vastavalt määratletud proportsioonile. Seetõttu järeldas Proust 1799. aastal, et kui mitu ainet ühendavad ühendi, tehakse seda alati määratletud massisuhtes.
Nii lõi ta seaduse, mida nimetatakse Prousti seadus, Püsivate proportsioonide seadus või Määratletud proportsioonide seadus, mis on öeldud järgmiselt:

See seadus ja Lavoisieri seadus (Massikaitse seadus) on nimetatud Kaaluseadused, sest nad räägivad massides seotud aineid.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Prousti seadus või püsivate proportsioonide seadus"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Juurdepääs 27. juunil 2021.