Iga rakk on seade, milles toimub spontaanne oksüdatsiooni-redutseerimise reaktsioon, mis tekitab elektrivoolu, mida omakorda kasutatakse selleks, et mõned seadmed töötaksid.
Need seadmed said oma nime, kuna esimese loodud aku leiutas Alessandro Veel 1800. aastal moodustasid selle tsingist ja vasest kettad, mis olid eraldatud leotatud puuvillaga soolvees. See komplekt paigutati üksteise peale, kuhjata kettad ja moodustades suure samba. Kuidas läks a aku plaate, hakati selle nimega kutsuma.

Patareid koosnevad alati kahest elektroodist ja elektrolüüdist. Positiivset elektroodi nimetatakse a katood ja siin on reaktsioon vähendamine. Negatiivne elektrood on anood ja siin on reaktsioon oksüdeerumine. Elektrolüüdi nimetatakse ka soolasild ja on iooni juhtiv lahus.
Kui soovite aru saada, kuidas see elektrivoolu tekitab, vaadake ühe esimese patarei, Danielli hunnik, milles oli anum vasksulfaadi lahusega (CuSO4 (aq)) ja sellesse lahusesse kastetuna oli see vaskplaat. Teises eraldi mahutis oli tsinksulfaadi lahus (ZnSO
4 (aq)) ja kastetud tsinkplaat. Need kaks lahust ühendati soolasilla abil, mis oli kaaliumsulfaadi lahusega (K2AINULT4 (aq)), mille otstes on klaasvill. Lõpuks ühendati need kaks plaati välise vooluahela abil lambiga, mille valgustus näitaks elektrivoolu läbimist: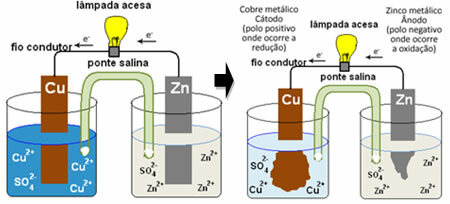
Mis juhtub, on see, et tsinkil on suurem kalduvus oksüdeeruda, see tähendab kaotada elektrone, nii et tera metalliline tsink töötab negatiivse elektroodina, anoodina, kus toimub oksüdeerumine: Zns) ↔ Zn2+(siin) + 2 ja-. Tsingi kaotatud elektronid transporditakse välise vooluahela abil vasele, tekitades elektrivoolu, mis lampi sisse lülitab. Lahuses olevad vaseioonid võtavad vastu elektrone (redutseerivad) ja muunduvad metallvaskiks, mis ladestub vasklehele. See tähendab, et see on positiivne elektrood, katood, kus reduktsioon toimub: Perse2+(siin) + 2 ja- ↔ perses).
Ärge lõpetage kohe... Peale reklaami on veel;)
Tänapäeva patareidel on sama tööpõhimõte, mille kohaselt üks metall annetab juhtiva lahuse kaudu teisele elektrone ja tekib elektrivool. Erinevus seisneb selles, et tänapäeval kasutatavad patareid on kuivad, kuna need ei kasuta elektrolüüdina vedelat lahust, nagu juhtub Danielli akus.
Tänapäeval on väga erinevaid patareisid, mida müüakse kaubanduslikult. Nende hulgas on kõige levinumad happelised rakud (Leclanchés) jaalkoholipatareid.
Mõlemal on negatiivse elektroodina tsink; teisest küljest on positiivse poolusena mangaandioksiidiga (MnO2), pulbristatud süsi (C) ja märg pasta. Erinevus seisneb selles, et happekuhjas kasutatakse niiskes pastas ammooniumkloriidi (NH).4Cl) ja tsinkkloriid (ZnCl2) - happelised soolad - lisaks veele (H2O). Leelispatareis kasutatakse kaaliumhüdroksiidi (KOH), mis on alus.

Leclanché patareid sobivad kõige paremini seadmetele, mis vajavad kerget ja pidevat tühjenemist, näiteks kaugjuhtimispult, seinakell, kaasaskantav raadio ja mänguasjad. Leelispatareidel on seevastu 50–100% rohkem energiat kui sama suurusega tavalisel patareil, mida soovitatakse seadmetele, mis vajavad kiiremat ja intensiivsemat allalaadimist, näiteks raadiod, CD / DVD-mängijad, kaasaskantavad MP3-d, taskulambid, digitaalkaamerad jne.

Lisateave selle ja muude tüüpi patareide elektrolüütide ja elektroodide kohta. mis tüüpi seadmete jaoks neid kõige rohkem soovitatakse, lugege rohkem vastavaid artikleid kolisema.
Autor Jennifer Fogaça
Lõpetanud keemia


