Mida kõrgem temperatuur, seda suurem on reaktsiooni kiirus.
Seda on meie igapäevaelu paljudes olukordades hõlpsasti näha, nagu näiteks järgmistes näidetes:
- Kui tahame toidu lagunemisreaktsiooni aeglustada, langetame temperatuuri, asetades selle külmkappi;

- Kui tahame kiirendada toidu valmistamisreaktsiooni, pange see lihtsalt keedupotti. rõhk, mis suureneva rõhu korral suurendab ka vedeliku keemistemperatuuri, milles toit on;

- Tulekahjud on tavaliselt laastavad, kuna keskkonna temperatuur tõuseb, mis põhjustab põlemisreaktsiooni kiiruse suurenemist;
- Ainevahetuslike keemiliste protsesside aeglustamiseks, vähendades selle tagajärjel tekkivat ajukahjustust hapnikupuudus, mõned operatsioonid tehakse patsiendi kehatemperatuuri langetamisega, jäädes umbes 15 ° C;
- Kui paneme kihiseva tableti klaasi kuuma vette ja teise klaasi külma vette, siis esimene lahustub palju kiiremini.
Kuid mis seletab temperatuuri otseselt proportsionaalset mõju reaktsioonikiirusele?
Ärge lõpetage kohe... Peale reklaami on veel;)
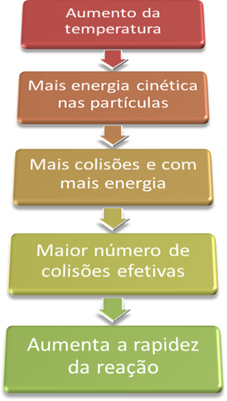
Seda seetõttu, et nagu selgitatud tekstisKeemiliste reaktsioonide esinemise tingimused”, Reaktsiooni kulgemiseks on vaja täita mõned tingimused, näiteks osakesed nad peavad kokku põrkama tõhusalt ja minimaalselt vajaliku energiaga, mida nimetatakse aktiveerimisenergiaks.
Seega, kui tõstame süsteemi temperatuuri, suurendame ka reageerivate osakeste segamist ja anname neile rohkem kineetilist energiat. Sellega toimub rohkem kokkupõrkeid ja suurema energiaga, mis suurendab reageerivate osakeste hulka ja seega reaktsioonikiirust.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Reaktsioonide temperatuur ja kiirus"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm. Juurdepääs 27. juunil 2021.


