Ensüümid on bioloogilised katalüsaatorid, mis vastutavad antud keemilise reaktsiooni kiiruse suurendamise eest. Ensüümid on tavaliselt valgud, kuid on ka mõned ribonukleiinhapped mis toimivad ensüümidena, mida nimetatakse ribosüümideks.
Reaktsiooni kiirendamiseks peavad ensüümid seonduma reagentidega, mida tuntakse substraatidena. Pikka aega arvati, et see seos esineb väga jäigalt, see on muster, mida nimetatakse klahvilukuks. hetkel, Kuid, aktsepteeritakse indutseeritud liitmisena tuntud mudelit., mis eeldab, et substraadi aktiivsesse kohta sisenemisel esinevad kerged muutused ensüümi kujul.
Loe ka: Mis on ainevahetus?
Mis on ensüümid?
Ensüümid on biomolekulid, mis toimivad katalüsaatoritena, st nad on ained, mis on võimelised kiirendama kiirust keemilised reaktsioonid mis esinevad elusolendites ilma nende reaktsioonide ajal tarvitamata. Ilma ensüümide toimeta oleksid mõned reaktsioonid väga aeglased, mis kahjustaks ainevahetust. Ensüümid kiirendavad selektiivselt reaktsioone ja on seetõttu väga spetsiifilised katalüsaatorid.
Ensüümid on võimelised reaktsiooni kiirendama, vähendades aktivatsiooni energiat, see tähendab, et nad vähendavad reaktsiooni käivitamiseks lisatava energia hulka.
[väljaande_omnia]
Kas iga ensüüm on valk?
Ehkki neid määratletakse sageli valguliste bioloogiliste katalüsaatoritena, mitte iga ensüüm ei ole valk. On mõned RNA-d, mis toimivad nagu ensüümid, mida nimetatakse ribosüümideks. Enamik ensüüme on siiski valgud, mis moodustuvad seetõttu aminohapped. Nende biomolekulide aminohappeline koostis määratleb kolmemõõtmelise struktuuri, mille ta omandab.
Loe ka: Kuidas katalüsaatorid toimivad?
Ensüümi-substraadi kompleks
Seda nimetatakse reaktiivi substraadiks, millel ensüüm toimib. Kui ensüüm seondub oma substraadiga, moodustub kompleks ensüüm-substraat. See seondumine toimub konkreetses piirkonnas, mida nimetatakse aktiivseks saidiks.
Kui räägime valgupõhistest ensüümidest, vastab aktiivne sait vaid mõnele aminohappele, ülejäänud molekul vastutab aktiivse saidi konfiguratsiooni määramise eest. Nii aktiivse saidi kuju kui ka substraadi kuju on seotud ensüümi spetsiifilisusega, kuna need peavad olema üksteist täiendavad.
Klahviluku mudel
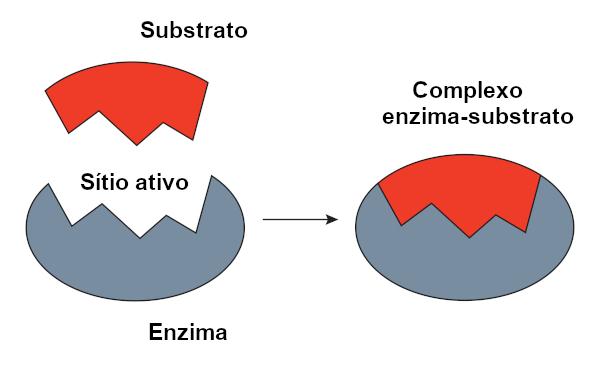
O klahviluku mudel, mida soovitas Emil Fischer, kasutatakse laialdaselt ensüümi ja substraadi koostoime selgitamiseks. Selle mudeli kohaselt on ensüümi ja substraadi vahel jäik komplementaarsus nagu võtmel ja lukul. Ensüümi aktiivsel saidil oleks substraadile täiendav kuju, mis sobiks ideaalselt. Seetõttu poleks teistel molekulidel juurdepääsu sellele saidile, mis tagaks ensüümi spetsiifilisuse. Nii nagu võti avab ainult luku, seondub ensüüm ainult substraadiga. Täna teame siiski, et see mudel pole õige, kuna ensüümid ei ole jäigad struktuurid, nagu varem arvati.
Indutseeritud sobiv mudel
Praegu on Enim aktsepteeritud mudel ensüümi ja selle substraadi vahelise seose selgitamiseks on üks klõps indutseeritud, mille algselt pakkusid välja Koshland jt. Aktiivne sait ja põhimik ei tööta jäigalt nagu võti ja lukk. Uuringud näitavad, et kui substraat siseneb aktiivsesse kohta, läbib ensüüm kerge modifikatsiooni, mis soosib sobivust aktiivse saidi ja substraadi vahel. Selle mudeli paremaks mõistmiseks võime ensüümi ja substraadi vastastikmõjust mõelda kui käepigistusest, mis muutub pärast esimest kokkupuudet kindlamaks.
Kofaktorid
Enamik ensüüme vajavad katalüütilise toime saavutamiseks abimolekule, mida nimetatakse kofaktoriteks. Kofaktorid võivad olla ensüümi külge püsivalt kinnitatud või substraadile nõrgalt ja pöörduvalt kinnitatud. Nad ka võivad olla anorgaanilised või orgaanilised. Kui kofaktorid on orgaanilised molekulid, nimetatakse neid koensüümid.
Mõned vitamiinid toimivad koensüümidena, see kehtib näiteks riboflaviini, tuntud ka kui B2-vitamiin. Anorgaaniliste kofaktorite näidetena võime nimetada rauda ja tsinki ioonsel kujul.
Loe ka: B-kompleksi vitamiinid - vitamiinide rühm, mis toimib üldiselt koensüümidena
Ensüümide klassifikatsioon
Ensüüme saab liigitada kuus rühma, kasutades kriteeriumina nende katalüüsitava reaktsiooni tüüpi.
Oksidoreduktaasid: ensüümid, mis on seotud oksirvähendamine.
Transferaasid: katalüüsida rühmade ülekandumist ühelt ühendilt teisele.
Hüdrolaasid: katalüüsida hüdrolüüsireaktsioone.
Valed: toimige rühmade lisamisega kaksiksidemetesse või eemaldades kaksiksideme moodustavad rühmad.
Isomeraasid: katalüüsida isomerisatsioonireaktsioone.
Lingid: ensüümid, mis põhjustavad ATP, kasutades selles reaktsioonis eralduvat energiat uute ühendite moodustamiseks.
Ärge lõpetage kohe... Peale reklaami on veel;)
Faktorid, mis reguleerivad ensüümi aktiivsust
Ensüümi aktiivsust mõjutavad tegurid, millest peamised on temperatuur ja pH. Temperatuur mängib keemilistes reaktsioonides üldiselt positiivset rolli, suurendades ensümaatilise reaktsiooni kiirust. Kui aga temperatuur kasvab üle optimaalsete tingimuste, reaktsioonikiirus langeb märkimisväärselt. Seda seetõttu, et täheldatakse valkude denaturatsiooni. Enamiku inimese ensüümide optimaalne temperatuur on vahemikus 35–40 ºC. Lisaks temperatuurile on pH see mõjutab ka ensümaatilist aktiivsust ja on ka optimaalne väärtus. Enamiku ensüümide puhul on optimaalne pH väärtus vahemikus 6 kuni 8.
Autor Vanessa Sardinha dos Santos
Bioloogiaõpetaja