THE päritolu Perioodilisustabel toimus 19. sajandi alguses, umbes 1829. aastal, kui tollased keemikud otsustasid välja pakkuda viise selle korraldamiseks keemilised elemendid seni teada.
19. sajandi alguses olid keemikutel teadmised mitmest omadusest (tiheduskolmekümne keemilise elemendi aatomimass, reaktsioonivõime, sulamistemperatuur, keemistemperatuur, füüsikaline olek). Need teadmised olid lähtepunktiks perioodilise tabeli päritolu.
200 aasta jooksul püüdsid mitmed keemikud välja pakkuda viise keemiliste elementide, st Perioodilisustabel, mida me täna teame, oli tegelikult erinevat päritolu, nagu läbi ajaloo oli palju katseid esitatakse.
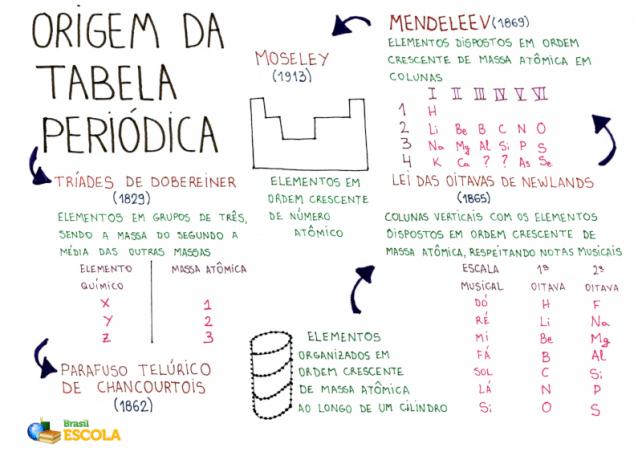
Meelekaart: Perioodilise tabeli päritolu
* Selle mõttekaardi allalaadimiseks Kliki siia!
Siin on mõned keemikud, kes on suurepäraselt püüdnud elemente tabelisse organiseerida.
Dobereineri triaadid

Joonistanud Johann Wolfgang Dobereiner *
Aastal 1829 korraldas Saksa keemik Johann Wolfgang Dobereiner ajaloo esimese perioodilise tabeli. Selles oli kolmkümmend seni teadaolevat keemilist elementi ja ta nimetas teda Dobereineri triaadiks.
THE Dobereineri perioodiline tabel seda nimetati triaadiks, kuna elemendid olid korraldatud 3-liikmelistes rühmades. Igas rühmas olid elemendid, millel olid sarnased keemilised omadused.
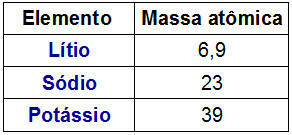
Dobereineri triaadi kujutamine
Dobereineri triaadide kohta on huvitav fakt, et aatommass kolmkõla keskelemendi väärtus oli täpselt kolmkõla ülejäänud kahe elemendi aatommasside vahelise aritmeetilise keskmise tulemus.

Alexandre de Chancourtoisi telluurikruvi
Aastal 1862 Prantsuse geoloog ja mineraloog Alexandre de Chancourtois ta otsustas välja pakkuda tol ajal tuntud keemiliste elementide organisatsiooni, et hõlbustada nende kasutamist mineraloogias. THE Chancourtoise laud seda nimetati telluurkruviks.

Chancourtoise telluurkruvi kujutis
Chancourtois jagas keemilised elemendid (pildil tumedad laigud) aatomimassi kasvavas järjekorras mööda silindris eksisteerivat spiraalset riba. Selle organisatsiooniga täheldas Chancourtois, et samale vertikaalsele joonele paigutatud elementidel on sarnased keemilised omadused.
Oktaavide seadus
Ärge lõpetage kohe... Peale reklaami on veel;)
Oktaavide seadus oli nimi, mille pakkus välja inglise keemik J.A.R. Newlands, aastal 1865 Perioodilisustabelile. Kuna Newlands on ka muusik, seadis ta laua nootide järgi (do, there, re, mi, fa, sol, there, si).
Newlands korraldas tol ajal teadaolevad 61 keemilist elementi aatomimassi kasvavas järjekorras ja paigutas need vertikaalsetesse veergudesse. Igal vertikaalsel veerul oli seitse elementi.
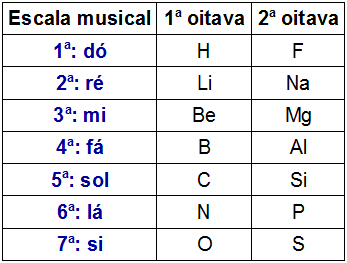
Newlandsi kahe oktaavi kujutis
Newlands täheldas, et erinevate oktavide samas horisontaaljoonel paiknevatel keemilistel elementidel olid sarnased keemilised omadused. Seega olid oktaavi esimesel elemendil sarnased omadused kui teise oktaavi esimesel elemendil jne.
Mendelejevi perioodilisustabel

Illustratsioon keemik Mendelejev **
Mendelejevkeemiliste elementidega töötamise ajal oli tal kombeks igaühe omadused kaartidele üles kirjutada. Mingil hetkel, aastal 1869, otsustas ta paigutada need märgid aatomimassi kasvavas järjekorras.
Kohe pärast elementide paigutamist aatomimassi kasvavas järjekorras jättis Mendelejev mustri alles, kuid - paigutatud elemendid horisontaalsesse ja vertikaalsesse veergu, pidades silmas süsteemi omadusi ja sarnasusi elemendid.
Moseley perioodiline tabel
Aastal 1913 oli inglise keemik HenryMoseley, mis põhines Mendelejevi pakutud tabelil, pani perioodilise tabeli kokku tänapäeval tuntud mustritega.
Erinevalt Mendelejevist korraldas Moseley elemendid kasvavas järjestuses aatomnumber, hoidis organisatsiooni horisontaalsetes ja vertikaalsetes veergudes, kuid paigutas samade keemiliste omadustega elemendid samadesse vertikaalsetesse veergudesse.
praegune perioodiline tabel
Pärast 1913. aastat ei toimunud Moseley pakutud perioodilisustabelis suuri muudatusi, tegelikult tehti selles mõned uuendused, kuna avastati mõned keemilised elemendid.
Võrreldes seda praeguse tabeliga, ei näidanud Moseley tabel näiteks keemilisi elemente, mille aatomnumbrid olid vahemikus 110 kuni 118. Lisaks paiknes aktiiniidide seeria lantaniidide seeria kohal.
THE viimane uuendus Perioodilisustabelis peeti 2016. aastal, kui elemendid 113, 115, 117 ja 118 said selle ametlikult osaks.
* Pildikrediit: Yangchao/ aknaluuk. Inc
** Pildikrediit: Olga Popova/ aknaluuk. Inc
Minu poolt. Diogo Lopes Dias