Z-tähega sümboliseeritud aatomnumber vastab antud keemilise elemendi aatomi tuumas eksisteerivate prootonite hulgale. Näiteks vesiniku aatomnumber on 1, mis tähendab, et selle aatomituumas on ainult 1 prooton.
Aatomnumber ilmub tavaliselt vasakul asuva keemilise elemendi alaindeksi sümboli kõrval (alumises nurgas). Näide: 1H.
Põhiasendis on aatomnumber võrdne elektronide arvuga, kuna selles olekus element on neutraalne, seetõttu peab positiivsete laengute (prootonite) hulk võrduma negatiivsete laengute (elektronide) kogusega aatom.
Aatomnumber on oluline, sest just tema määrab perioodilise tabeli elemendi peamised omadused ja omadused, samuti selle käitumise ja asukoha. Elemendid on perioodilisustabelis loetletud aatomnumbri kasvavas järjekorras, mis tavaliselt kuvatakse elemendi kohal, nagu allpool näidatud. Pange tähele, et esimene element on vesinik, H (Z = 1), millele järgneb heelium, He (Z = 2), seejärel tuleb liitium, Li (Z = 3) jne.
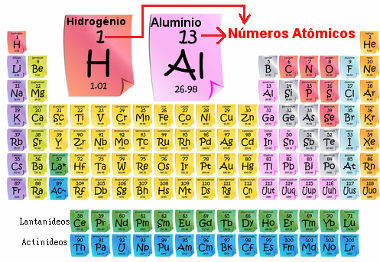
Perioodilisustabeli elementide aatomarv
Keemilise elemendi võime isegi kontseptualiseerida olemisena
"Aatomite hulk, millel on sama aatomnumber". Seega, kui räägime näiteks hapniku keemilisest elemendist, siis aatomnumbriga 8 aatomitest. Allpool on perioodiliste tabelite perioodide 1 ja 2 keemiliste elementide aatomid aatomnumbri kasvavas järjekorras:
Perioodilise tabeli 1. ja 2. perioodi keemilised elemendid aatomnumbri kasvavas järjekorras
Ärge lõpetage kohe... Peale reklaami on veel;)
Aatomnumbrid määratles algselt inglise füüsik Henry Gwyn Jeffreys Moseley (1887–1915) ning erinevate elementide pommitamisega seotud katsete läbiviimisel röntgenikiirtega keemikud, täheldas ta, et aatomituuma kiirgamisel tekkiva röntgenikiiruse ruutjuur oli otseselt proportsionaalne tabeli elemendi aatomnumbriga Perioodiline. Sellega jõudis ta järeldusele, et aatomnumber oli seotud aatomite omadustega, kuna see esindas positiivsete laengute arvu iga aatomi tuumas.
Keemilised sidemed ei mõjuta aatomite aatomite arvu, kuna need hõlmavad ainult elektrosfääris olevaid elektrone. Tuumareaktsioonid hõlmavad aga aatomituuma ja seetõttu on lisatud ka aatomnumber.
Näiteks kui osakesed (peamiselt mõõdukad neutronid) pommitatakse raskele, ebastabiilsele aatomituumale, on see tuum purustatud ja tekitab kaks väiksemat aatomituumat, st väiksema arvu prootonite ja neutronitega, vabastades kolossaalse koguse energia.
Tuumasüntees on seevastu vastupidine protsess, see on siis, kui kaks väikest ja kerget tuuma ühinevad, tekitades suurema ja stabiilsema tuuma, vabastades veelgi suurema hulga energiat.
Seega, kui need tuumareaktsioonid toimuvad, tekivad uued keemilised elemendid, kuna algelementide aatomnumbrid erinevad lõplike elementide aatomnumbritest. Näiteks vaadake allpool, et aatomnumbriga 92 uraani-235 lõhustumisel tekib baarium (Z = 56), krüptoon (Z = 36) ja kolm neutronit:

Uraani-235 tuuma lõhustumisreaktsioon
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Mis on aatomnumber?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm. Juurdepääs 27. juunil 2021.

