Nagu on näidatud tekstides "Keemiliste elementide elektromagnetiline spekter"ja"Emissiooni- ja neeldumisspektrid ning Kirchhoffi seadused”, On iga keemilise elemendi katkematu emissiooni spektrid erinevad.

Seega on allpool mõnede nende elementide erinevad spektrid:

Nii mõistis Taani füüsik Niels Böhr (1885-1962), et see võib olla seotud kõigi nende elementide aatomi struktuuriga. Niisiis pakkus ta välja aatommudeli, mis täiendaks Rutherfordi mudelit, kuid keskendus aatomituumas olevate ümbritsevate elektronide käitumisele.
Mõni aeg varem oli Max Planck (1858–1947) välja pakkunud teooria, et elektronid on kvantiseeritud, selles mõttes, et nemad eraldavad ja neelavad teatud koguses energiat, justkui oleksid need väikesed energiapakikesed, millele ta helistas kui palju (kvant, ainsuses).
Seega pakkus Böhr välja järgmist: kuna igal elemendil on erinev spekter, on iga elemendi aatomi elektronides konstantsed ja erineva energiaga elemendid.
Iga elektron saab viibida ainult teatud kindlal orbiidil, sest igas neist orbiitidest on elektronil konstantne, täpselt määratletud ja iseloomulik energia. Elektron saab hõivata ainult need energiatasemed, mille jaoks tal on vastav energia.
Ärge lõpetage kohe... Peale reklaami on veel;)
Spektrid on katkendlikud, kuna elektronid on kvantiseeritud.
Elektron saab taset muuta ainult siis, kui see neelab energiat. Näiteks kui põletate naatriumsoola Bunseni põletis, siis varustate elektronidega energiat. Energiakvandi neelamisel hüppab elektron teisele energeetilisemale tasemele, püsides ergastatud olekus. Kuid põhiolukord on stabiilsem, nii et see elektron kiirgab neeldunud energiat ja naaseb oma algsele orbiidile. See kiirgab seda energiat elektromagnetlainete kujul, mida saab valguse kujul visualiseerida. Naatriumi puhul on see valgus intensiivselt kollast värvi. Seega, kui need lained läbivad prisma, saadakse katkendlik naatriumispekter.
Nii et Böhri jaoks iga helendav joon, mis ilmus elementide katkematus spektris, näitas energiat, mis vabanes, kui elektron naasis väliselt tasandilt tuumale lähemale.
Allolev joonis aitab seda probleemi paremini mõista:
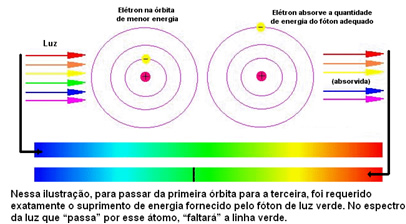
Kuna iga elemendi aatomitel on lubatud ainult teatud energiakihid, mis vastavad energiakihtidele, on iga elemendi jaoks erinev spekter.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Elektromagnetilised spektrid ja aatomite struktuur"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm. Juurdepääs 27. juunil 2021.