Dissotsiatsioon alused see on füüsiline protsess mis tekib selle olulise anorgaaniliste ainete rühma puhul, kui need on vees lahustunud, või kui nad läbivad termotuumasünteesi (läbipääs tahkest vedelast olekust läbi küte).
Üldiselt on nähtus aluse dissotsiatsioon selle moodustavad katioonid ja anioonid ioonne ühend, mis antud juhul on aluseks. Niisiis, ajal aluse dissotsiatsioon, vabastamine ioonid mis ühendis juba olemas on, see tähendab, et uusi ioone ei moodustu.
Aluse moodustab mis tahes metall (X), mis on ühendi katioon, või ammooniumkatioon (NH-rühm4+), mis on seotud hüdroksiidaniooniga (mida esindab OH-rühm), nagu allpool esitatud:
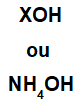
Alusvalemi üldised esitused
vormis esindavad aluse dissotsiatsioon seda tehakse võrrandi kaudu, milles reagendis on meil alus ja saadustes ioonid (katioonid ja anioonid). Erinevus seisneb selles, kuidas dissotsiatsioon toimub:
Aluse lahustamine vees:
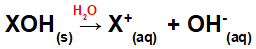
Võrrand, mis tähistab aluse dissotsiatsiooni vesikeskkonnas
Lahkumine baasühinemise teel:
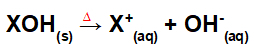
Võrrand, mis tähistab aluse dissotsieerumist termotuumasünteesi protsessis
Analüüsides ülaltoodud üldvõrrandeid, kontrollime, et kõigis neist on meil alati alus, katioon (mis on metalli või NH rühm4+) ja anioon (OH-). Kuid kas nad kõik on sellised? Kas neil pole vahet? Esimesele küsimusele on vastus eitav ja teisele küsimusele jah.
Ärge lõpetage kohe... Peale reklaami on veel;)
Kui me teostame baasist eraldumine, on esmalt oluline analüüsida põhivalemit, sest selle põhjal saame määrata katiooni ja hüdroksiidanioonide mol kogus, kuna katiooni mol kogus on standardne (alati 1 mol).
Tasub meeles pidada, et alusvalemis esinevate OH-rühmade kogus määrab katiooni laengu ja aluse dissotsiatsioonis oleva hüdroksiidaniooni koguse molides.
Vaatame alumiiniumhüdroksiidi näiteid [Al (OH)3] ja kuldhüdroksiid (AuOH). Alumiiniumi alusvalemis on kolm OH-rühma ja kulla-põhivalemis ainult üks OH-rühm. Seega on nende aluste dissotsieerimisel meil:
Al (OH) dissotsiatsioon3:
Kuna sellel alusel on valemis kolm OH-rühma, on katiooni laeng +3 ja anioonide kogus molides võrdub 3 moliga, nagu näeme järgmises võrrandis:
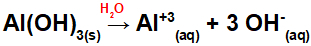
Alumiiniumi aluse dissotsiatsiooni võrrand vesikeskkonnas
Lahkumine AuOH-st:
Kuna sellel alusel on valemis OH-rühm, on katiooni laeng +1 ja anioonide kogus molides võrdub 1 moliga, nagu näeme järgmisest võrrandist:
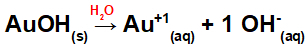
Aluse dissotsiatsiooni võrrand kullaga vesikeskkonnas
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Mis on baaside dissotsiatsioon?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm. Juurdepääs 27. juunil 2021.
Keemia

Dissociation and Ionization, Itaalia teadlane Volta, elektrivool, Rootsi füüsikaline keemik Svant August Arrhenius, teooria Arrhenius, positiivsed ioonid, katioonid, negatiivsed ioonid, anioonid, seebikivi, lauasool, polaarmolekulid, dissotsiatsioon ioonne,