Kui valmistame oma kodus toitu, kasutame toiduvalmistamise gaasi põletamist. Üks asi, mida näeme selle gaasi põlemisel tekkivas leegis, on see, et selle värv on tavaliselt väga helesinine. Kuid enamikes põlemisreaktsioonides, näiteks küünla põletamisel, on leek kollane.

Siis tekib küsimus:
"Kui iga tulekahju on põlemisreaktsiooni tagajärg, siis miks on mõnel leegil erinevad värvid?"
Et mõista, kuidas see juhtub, peame mõistma, mis on põlemisreaktsioon ja milliseid aineid leidub igas nimetatud reaktsioonis.
Põlemisreaktsioon toimub siis, kui oksüdeerija (hapnikku sisaldav gaasiline materjal) tarbib kütust (oksüdeeruvat materjali) soojusenergia (soojuse) saamiseks.
Teine oluline punkt, mida peame põlemisreaktsioonide kohta teadma, on see, et need võivad toimuda a täielik või puudulik. Kui kütuse tarbimiseks on piisavalt hapnikku, on reaktsioon täielik ja tekib süsinikdioksiid (CO2) ja vesi (H2O). Vastasel juhul toimub põlemine osaliselt, mittetäielikult, tekitades süsinikmonooksiidi (CO) ja vett; või süsinik (C) ja vesi.
Mõlemal juhul analüüsime oksüdeerijat õhus leiduvat hapnikku. Kütused on siiski erinevad. Küpsetusgaas on tegelikult veeldatud naftagaas (LPG), mis on süsivesinike (alkaanide) segu, peamine kütus on butaan (C4H10). Seega koosneb keedugaas alkaanimolekulidest, millel on ainult kolm või neli süsinikuaatomit, sellepärast on selle põlemiseks täielikult vaja vähe hapnikku. Seda reaktsiooni saab väljendada järgmiselt:
1C4H10 g + 13/2 O2 g) → 4 CO2 g) + 5 tundi2Og), ∆H <0
Ärge lõpetage kohe... Peale reklaami on veel;)
Küünalde puhul on reaktsiooni kütuseks parafiin ja see koosneb süsinikuaatomitega alkaanide segust, mis vahemikus 20 kuni 36. Seeläbi selle reaktsiooni täielikuks toimumiseks on vaja palju rohkem hapnikku. Vaadake näidet:
1C24H50 (s) + 70/2 O2 g) → 25 CO2 g) + 25 H2Og), ∆H <0
Õhus ei ole selle täieliku põlemise läbiviimiseks piisavalt hapnikku, seega toimub see mittetäielikult, nagu allpool näidatud:
1C24H50 (s) +49/2 O2 g) → 24 COg) + 25 H2Og), ∆H <0
1C24H50 (s) +25/2 O2 g) → 24Cs) + 25 H2Og), ∆H <0
Mittetäielikud reaktsioonid toodavad vähem energiat kui täielik põlemine. See seletab leekide värvide erinevust, kuna mittetäielikule põlemisele iseloomulikul kollasel leegil on madalam energia. Sinine leek on iseloomulik täielikule põlemisele, suurema energiaga.
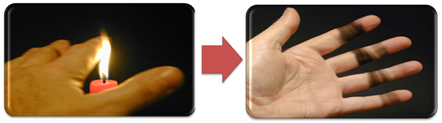
See seletab tahma teket ka küünlaleegiga (alloleval pildil), mis on süsinik, mida peetakse mittetäieliku põlemise produktiks.
Kuid miks on Bunseni põletis võimalik saada kollast ja sinist leeki, kui kütus ei muutu?
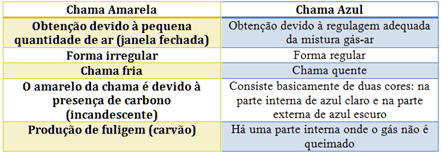
Bunseni põleti puhul saavutatakse see gaasi ja õhu sisselaskeava reguleerimisega. Kui aken on suletud, põhjustades väikese koguse õhu sisenemist, on saadud leek kollane, kuna täieliku põlemise läbiviimiseks on sellel vähe hapnikku. Kui gaasi-õhu segu reguleerimine on piisav, saame sinise leegi.
Vaadake igaühe omadusi allolevas tabelis:
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Erinevat värvi põlemine ja leegid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm. Juurdepääs 28. juunil 2021.