Enne kui rääkida nomenklatuurist a kvaternaarne ammooniumsool korralikult on oluline meeles pidada, mis see orgaaniline ühend on. Kvaternaarne ammooniumsool pärineb ammooniumkatioonis sisalduvate vesinike asendamisest (NH4+) per radikaalid orgaaniline, nagu allpool näidatud:
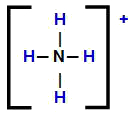
Ammooniumkatiooni struktuurivalem
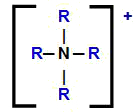
Ammooniumkatiooni struktuurivalem koos vesinikega, mis on asendatud orgaaniliste radikaalidega
Lisaks vesinike asendamisele on igal kvaternaarsel ammooniumsoolal ammooniumist saadud katiooniga kaasas mõni anioon. Seega võime selle ühendi üldist struktuurivalemit esitada järgmiselt:
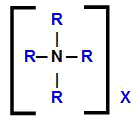
Kvaternaarse ammooniumsoola üldine struktuurivalem
Seega on ilmne, et kvaternaarse ammooniumsoola valemis on meil neli orgaanilist radikaali, sama või erinev, ja mis tahes anioon (X). Nende ühendite nomenklatuuri teostamiseks peame seda fakti arvestama.
Vaadake, kuidas kvaternaarse ammooniumsoola nomenklatuur vastavalt IUPAC-ile (Rahvusvaheline puhta ja rakendusliku keemia liit):
Aniooni nimi + de + radikaalide nimi tähestikulises järjekorras + ammoonium
Nüüd järgige mõnda näited reegli kohaldamine kvaternaarsete ammooniumsoolade nomenklatuur:
Bensüüloktadetsüüldimetüülammooniumjodiid
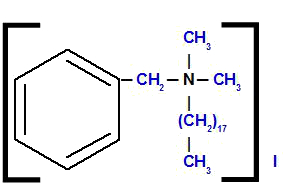
Struktuuri analüüsides täheldame, et anioon ühendis on Mina, mida nimetatakse jodiid. Struktuurist vasakul on meil radikaal bensüül (benseeni ristumiskoht CH rühmaga2). Üleval ja paremal on meil kaks radikaali metüül (CH3), mida nimetatakse dimetüüliks. Allosas on meil radikaal oktadetsüül, mille ahelas on kaheksateist süsinikuaatomit.
Ärge lõpetage kohe... Peale reklaami on veel;)
Seega algab nimi jodiidiga, millele järgneb eessõna pluss nimi bensüül, millele järgneb oktadetsüül (tähestikulise järjekorra tõttu) ja lõpuks dimetüül ammooniumiga.
Vaatlus: Mõisted okt ja di ei osale liitnime tähestikulises järjestuses.
tetraetüülammooniumkloriid
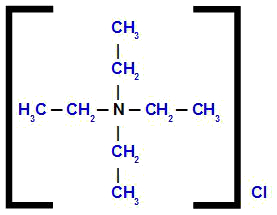
Struktuuri analüüsides täheldame, et anioon ühendis on Cl, mida nimetatakse kloriid. Neli struktuuris esinevat orgaanilist radikaali on etüül (CH3-CH2-); seetõttu saavad nad nime tetraetüül.
Seega algab nimi kloriidiga, millele järgneb eessõna pluss nimi tetraetüül, millele järgneb mõiste ammoonium.
Bensüültridetsüüldimetüülammooniumbromiid

Struktuuri analüüsides täheldame, et anioon ühendis on br, mida nimetatakse bromiid. Struktuurist vasakul on meil radikaal bensüül (benseeni ristumiskoht CH rühmaga2). Üleval ja paremal on meil kaks radikaali metüül (CH3), mida nimetatakse dimetüüliks. Allosas on meil radikaal tridetsiil, kuna selle ahelas on kolmteist süsinikuaatomit.
Seega algab nimi jodiidiga, millele järgneb eessõna pluss nimi bensüül, millele järgneb tridetsüül (tähestikulise järjekorra tõttu) ja lõpuks dimetüül ammooniumiga.
Difenüüldimetüülammooniumsulfaat
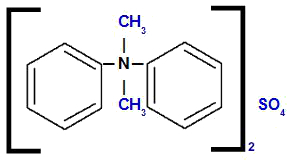
Struktuuri analüüsides täheldame, et anioon ühendis on AINULT4, mida nimetatakse sulfaat. Struktuuri vasakul ja paremal on fenüülradikaal (benseen), mida nimetatakse difenüüliks. Üla- ja alaosas meil on metüülradikaalid (CH3), mida nimetatakse dimetüüliks.
Seega algab nimi sulfaadiga, millele järgneb eessõna pluss nimi difenüül, millele järgneb dimetüül (tähestikulise järjekorra tõttu) ja lõpuks ammoonium.
Minu poolt. Diogo Lopes Dias