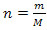Gaas ja aur
Gaasi ja auru vahe antakse kriitilisest temperatuurist. Aur on aine gaasilises olekus, olekus, mida saab suureneva rõhu korral vedeldada. Gaas pole sama. See on vedelik, mida ei saa lihtsa rõhu tõstmisega vedelaks muuta. See muudab gaasi aurust erinevaks.
Gaaside käitumine
Antud aine gaasilises olekus on gaas, kui selle temperatuur on kõrgem kui kriitiline temperatuur, kui temperatuur on võrdne või madalam kriitilisest temperatuurist, kui aine on aur.
Tegelikud gaasid, mida me tavaliselt teame, näiteks heelium, lämmastik ja hapnik, omavad igaühe erinevaid ja konkreetseid molekulaarseid omadusi. Kui me aga paneme need kõik kõrgele temperatuurile ja madalale rõhule, hakkavad nad käituma väga sarnaselt. Gaaside uurimisel võetakse kasutusele lihtne teoreetiline mudel, mida praktikas ei eksisteeri, käitumine sarnaneb tegelike gaaside käitumisega. See lähendamine muutub paremaks, seda madalam on rõhk ja kõrgem temperatuur. Seda gaasimudelit nimetatakse ideaalne gaas.
Umbes 17. ja 19. sajandil on kolm teadlast (Jacques Charles, Louis J. Gay-Lussac ja Paul E. Clayperon) töötasid pärast gaaside käitumise uurimist välja seadused, mis reguleerivad ideaalsete gaaside käitumist, mida nimetatakse ka ideaalseteks gaasideks. Nende poolt määratud seadused kehtestavad ideaalse gaasi „välise” käitumise reeglid, mis viivad see loeb ainult nendega seotud füüsikalised suurused, milleks on: maht, temperatuur ja surve.
Täiuslike gaaside üldine seadus
Avaldust, mis määrab täiuslike gaaside üldise seaduse, võib näha järgmiselt:
Ärge lõpetage kohe... Peale reklaami on veel;)
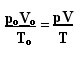
kus lkO, VO ja TO need on vastavalt algrõhk, algmaht ja algtemperatuur. Seda väljendit kasutatakse juhul, kui gaasi muutujad erinevad.
boyle'i seadus
Füüsik ja keemik Robert Boyle oli see, kes määras seaduse, mis reguleerib gaasi toimuvaid muutusi, kui selle temperatuuri hoitakse konstantsena. Tema seadus ütleb, et kui gaas isotermiliselt muundub, on selle rõhk pöördvõrdeline hõivatud mahuga. Sellest seadusest saame, kuidas TO = T Me peame:
POVO = pV
Karli seadus
Karli seadus on seadus, mis reguleerib täiusliku gaasi muundumist püsivaks mahuks. Neid teisendusi nimetatakse isohoorseteks või isomeetrilisteks teisendusteks. Selle seaduse kohaselt on ideaalne gaasimassi isokoorne muundumine selle rõhk otseselt proportsionaalne absoluutse temperatuuriga. Matemaatiliselt võib seda seadust väljendada järgmiselt:

kus lkO ja TO need on vastavalt algrõhk ja algtemperatuur.
Gay-Lussaci seadus
Gay-Lussaci seadus on seadus, mis reguleerib täiusliku gaasi teisendusi pideva rõhu all. Selle seaduse, hoolimata sellest, et see kannab nime Gay-Lussac, oli füüsik ja keemik A. C. Charles juba avastanud. Seaduse kohaselt on gaasi isobaarilise muundumise korral gaasi maht otseselt proportsionaalne selle absoluutse temperatuuriga. Matemaatiliselt võib seda seadust väljendada järgmiselt:

Kus VO ja TO vastavad vastavalt algmahule ja algtemperatuurile.
Autor Marco Aurélio da Silva
Näe rohkem!!
Gaasi muundamine
Tea, mis on gaasi muundamine.
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
SANTOS, Marco Aurélio da Silva. "Gaaside uurimine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Juurdepääs 27. juunil 2021.