Aatomid on lõpmata väikesed osakesed, mis moodustavad kogu universumis oleva aine. Aja jooksul muutus idee, milline oleks aatomi struktuur, vastavalt teadlaste tehtud uutele avastustele. Selle kohta saate rohkem teada tekstistAatomimudeli areng.
Mudel on tegelikkuse (mitte reaalsuse enda) esitus, seega on aatomimudelid selle esitus peamised aatomi komponendid ja selle struktuur ning selgitavad aine teatud füüsikalist ja keemilist käitumist. Seda tehakse seetõttu, et inimesel pole veel ultramikroskoopidega võimalik isoleeritud aatomit näha.
Et teada saada, kui väike aatom on, teadke seda The Väikseim tavalise mikroskoobi all nähtav osake sisaldab üle kümne miljardi aatomi! Aatom on nii väike, et, kui paneksime neist miljon kõrvuti, ei jõuaks me juuste paksus.
Meelekaart: Atom
* Mõttekaardi allalaadimiseks PDF-failina Kliki siia!
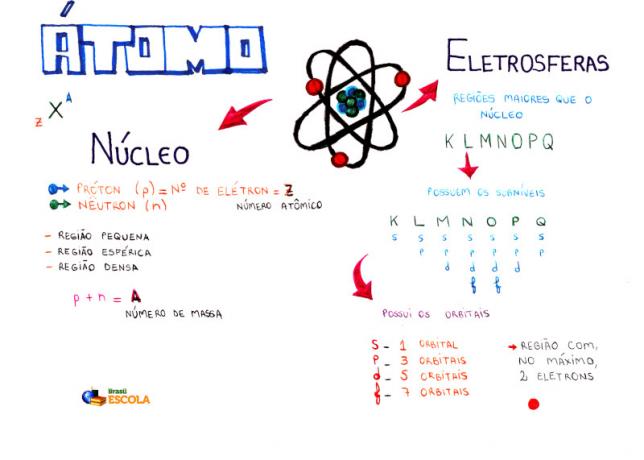
Aatomimudelite seas on praegu keskkoolis kõige enam kasutatav aatomi struktuuri ja selle omaduste mõistmiseks Rutherford-Bohri mudel. Selle mudeli järgi koosneb aatomi struktuur kahest põhiosast: tuum ja elektrosfäär.

Aatomi struktuuri kaks peamist osa - elektrosfäär ja tuum
* Tuum: Olles aatomi keskosa, on see kompaktne, massiivne ja väga tihe, lisaks moodustub suurema massiga osakestest, milleks on prootonid ja neutronid.

Aatomituuma moodustavate prootonite ja neutronite illustratsioon
- prootonid: need on positiivse elektrilaenguga osakesed (suhteline laeng = +1; laeng kulomina (C) = +1,602. 10-19) ja selle suhteline mass on 1.
Selle, et prootonid moodustavad tuuma ja annavad sellele üldise positiivse laengu, avastas Eugen Goldstein, 1886. aastal Crookesi ampulli modifikatsiooni ja mõningate katsete kaudu. Ta nägi, et väga kõrgete pingete korral ilmnesid heitkogused (anoodkiired - pirni sees olnud gaasi aatomijäänused, mille elektronid purunesid elektrilahendusega). Paigutades elektri- või magnetvälja pirnist välja, suunati need kiired negatiivse pooluse poole. See tähendas, et oli positiivseid subatoomilisi osakesi, mida nimetati prootoniteks.
Hiljem Ernest Rutherford (1871-1937) viis läbi tekstis kirjeldatud katse Rutherfordi Atom, mis viis ta prootoni asukoha avastamiseni: tuumas.
- neutronid: need on osakesed, mille mass on võrdne prootonite (1) massiga, kuid nagu nimigi ütleb, on nad neutraalsed, st neil puudub elektrilaeng.
Neutronid avastasid 1932. aastal James Chadwick (1891-1974), kes mõistis, et radioaktiivse berülliumi tuum eraldas neutraalseid osakesi, mille mass oli ligikaudu võrdne prootonite massiga (tegelikult on see veidi suurem).
Ärge lõpetage kohe... Peale reklaami on veel;)
Tuuma läbimõõt sõltub aatomi prootonite ja neutronite hulgast, kuid keskmiselt on see umbes 10-14 10. kuu-15 m.
Aatomituum koondab praktiliselt kogu aatomi massi, olles väga väike osa: nii prooton kui ka neutron on umbes 100 000 korda väiksemad kui kogu aatom ise! Võrdluseks võib ette kujutada, et suurendame vesinikuelemendi aatomi tuuma (millel on ainult prooton) tennisepalli suurusele, lähim elektron oleks umbes kolme kilomeetri kaugusel kaugus! Isegi kui aatom suurendataks 14-korruselise hoone kõrgusele, oleks selle tuum seitsmendal korrusel pelgalt soolatera mõõtu. See on tõesti hämmastav, kas sa ei arva?
* Elektrosfäär: On piirkond, kus tuuma ümber pöörlevad elektronid. Vaatamata tuumast palju suurema ruumalaga piirkonnale on see praktiliselt tühi, kuna iga elektron on 1836 korda väiksem kui 1 prooton (või rohkem kui 1 neutron). Sellepärast on aatomi mass praktiliselt kogu tuumas. Elektronid on negatiivse elektrilaenguga (-1) osakesed.
Elektronid avastasid 1897. aastal Joseph John Thomson (1856–1940), looja Thomsoni aatomimudel. Thomsoni katset saab tekstist üksikasjalikult näha Thomsoni eksperiment elektrilahendustega, kuid lühidalt öeldes kasutas ta ülalmainitud Crookes'i ampulli ja mõistis, et katoodkiired olid alati meelitas positiivne poolus, mis tõestas, et aatomil olid negatiivsed osakesed, mida nimetati elektronid.
Elektronid pöörlevad tuuma ümber miljardeid kordi sekundisekundis, moodustades aatomi ja pannes käituma nagu tahke.
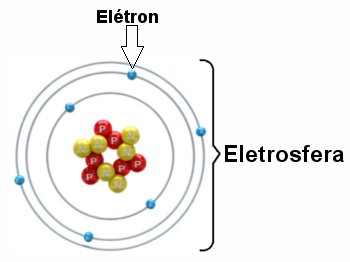
Kolme elektroonilise kihi ja tuuma ümber pöörlevate elektronidega elektrosfääri illustratsioon.
Lühidalt, saame koostada tabeli, et eristada kolme peamist subatomaarset osakest, mis on aatomi struktuuri osa:

Kolme peamise subatoomse osakese - prootonite, neutronite ja elektronide - mass ja elektrilaeng
Kõigi keemiliste elementide aatomid koosnevad neist kolmest aatomi osakestest. Ühte keemilist elementi eristab teisest nende osade ilmnemise kogus, eriti prootonite hulk tuumas, mida nimetatakse aatomnumbriks. Jätkake selle uurimist teksti kaudu. Keemiline element.
* Minu mõttekaart. Diogo Lopes
Autor Jennifer Fogaça
Lõpetanud keemia
Keemia
Aine, vee, vesiniktsüaniidgaasi, süsinikdioksiidi, ammoniaagi, vesiniku, heeliumi, ainete klassifikatsioon lihtsad ühendühendid, segud, segu faasid, homogeenne segu, segu heterogeenne.


