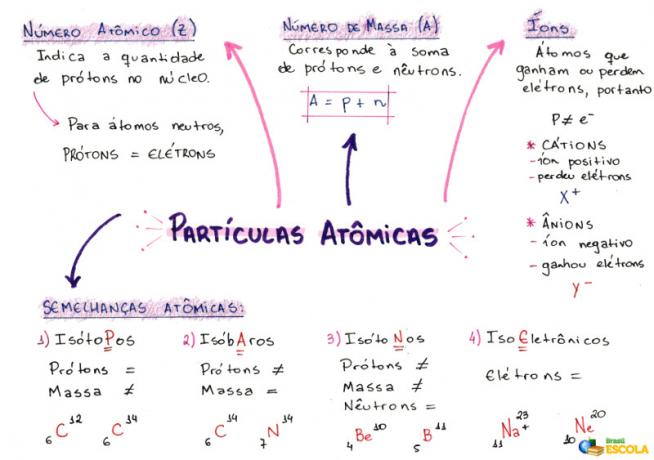
O aatomiosakeste arvu arvutamine kasutatakse mis tahes aatomi või iooni prootonite (tuumas), elektronide (elektrosfääris) ja neutronite (tuumas) märkimiseks. Selleks on oluline teada aatomite mõningaid omadusi:
1- aatomnumber (Z)
See on matemaatiline kood, mida tähistab suur täht Z ja mis paikneb aatomi lühendi vasakus alumises servas:
ZX
See näitab prootonite arvu (p) tuumas ja elektronide (e) arvu aatomi elektrosfääris. Nii et üldiselt:
Z = p = e
2- Massinumber (A)
See on matemaatiline kood, mis vastab mis tahes aatomi tuumas leiduvate prootonite (p) ja neutronite (n) arvule. Massiarvu tähistava võrrandi annab:
A = p + n
Kuna prootonite arv on võrdne aatomnumbriga, võime massi numbri arvutamiseks võrrandi kirjutada järgmiselt:
A = Z + n
Kui teame aatomi massi ja aatomnumbrit, saame neutronite arvu määrata järgmiselt:
n = A - Z
3- ioonid
Need on aatomid, mis kaotavad või omandavad elektrone. Nende kujutise paremas ülanurgas on positiivne või negatiivne märk, nagu järgmises mudelis:
X+ või X-
Positiivne ioon: seda nimetatakse katiooniks ja positiivne märk näitab, et see on kaotanud elektronid.
Negatiivne ioon: seda nimetatakse aniooniks ja negatiivne märk näitab, et see on saanud elektrone.
Ärge lõpetage kohe... Peale reklaami on veel;)
4- Aatomi sarnasused
a) isotoopid
Aatomid, millel on sama aatomnumber ja erinevad massinumbrid. Näide:
7X14 ja 7Y16
Aatomitel X ja Y on sama aatomnumber (lühendist vasakul), see tähendab, et see on võrdne 7-ga. Aatomil X on massinumber (akronüümi paremal) 14 ja aatomil Y massinumber 16.
b) isobaarid
Aatomid, millel on sama massinumber ja erinevad aatomnumbrid. Näide:
15X31 ja 13Y31
Aatomite X ja Y massarv (akronüümist paremal) on 31. Seevastu aatomil X on aatomnumber võrdne 15 ja aatomil Y aatomnumber 13.
c) isotoonid
Aatomid, millel on erinev massinumber ja aatomnumber, kuid sama palju neutroneid.
d) isoelektroonika
Aatomid, millel on sama arv elektrone. Näide:
12X+2 ja 7Y-3
Aatomil X on aatomnumber võrdne 12 ja see on katioon (positiivse laenguga +2), nii et see kaotab kaks elektroni, nii et selle elektrosfääris on 10 elektroni. Seevastu aatomil Y on aatomnumber võrdne 7 ja see on anioon (negatiivse laenguga -3), seega saab see kolm elektroni, nii et selle elektrosfääris on 10 elektroni.
Meelekaart: aatomiosakesed
* Mõttekaardi allalaadimiseks PDF-failina Kliki siia!
Näited aatomiosakeste arvu arvutamisest
Näide 1: Määrake prootonite, neutronite ja elektronide arv aatomis 14X29.
Aatomi X jaoks anti järgmised väärtused:
Massinumber (üleval paremal) = 29
Aatominumber (all vasakul) = 14
Prootonite arvu määramiseks tehke järgmist.
Prootonite arv on alati võrdne aatomnumbriga, seega on X aatomil 14 prootonit.
Elektronide arvu määramiseks tehke järgmist.
Kuna aatom X ei ole ioon, on elektronide arv võrdne prootonite arvuga, see tähendab 14-ga.
Neutronite arvu määramiseks tehke järgmist.
Neutronite arv määratakse massi ja prootonite arvu abil järgmises valemis:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Näide 2: Määrake iooni X prootonite, neutronite ja elektronide arv+3, teades, et nende massinumber ja aatomnumber on vastavalt 51 ja 23.
Ioonile X anti järgmised väärtused:
Massinumber = 51
Aatominumber (all vasakul) = 23
Prootonite arvu määramiseks tehke järgmist.
Prootonite arv on alati võrdne aatomnumbriga, seega on X aatomil 23 prootonit.
Elektronide arvu määramiseks tehke järgmist.
Ioon X on positiivne (+3), seega on see katioon, mis on kaotanud kolm elektroni. Seega on selle elektronide arv 20.
MÄRGE: Elektronide arvu vähenemine või suurenemine toimub alati aatomnumbri suhtes.
Neutronite arvu määramiseks tehke järgmist.
Neutronite arv määratakse massi ja prootonite arvu abil järgmises valemis:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Näide 3: Aatomi W aatomnumber ja mass on võrdsed vastavalt 29 ja 57, olles a-tähe isobar aatom Y, mille aatomnumber on 30, mis on aatomi B isotoop, mille massinumber on 65. Selle teabe abil määrake aatomi B prootonite, neutronite ja elektronide arv.
Harjutuse andmed:
Aatom W
aatomnumber (all vasakul) = 29
massinumber (paremal ülal) = 57
Y isobaar, st Y mass on samuti 57.
Y aatom
aatomarv = 30
massinumber = 57
Nende kahe väärtuse korral peame määrama selle neutronarvu, kuna see on elemendi B isotoon:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Aatom B:
massinumber = 65
neutronite arv = 27
Nende andmete põhjal peame määrama selle aatomnumbri, sest sellega määrame selle prootonite arvu ja elektronide arvu (kuna see pole ioon):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Seetõttu on aatomil B 38 prootonit, 38 elektroni ja 27 neutronit.
* Victor Ricardo Ferreira mõttekaart
Keemiaõpetaja
Minu poolt. Diogo Lopes Dias


