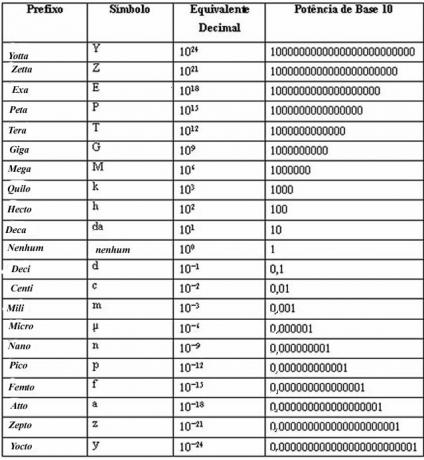
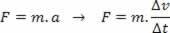Isovolumetrilistes protsessides jääb maht konstantseks ja seetõttu tööd ei tehta. Keskkonnaga vahetatav soojus võrdub süsteemi siseenergia muutusega (vt ülaltoodud diagrammi).
Esimese termodünaamikaseaduse kohaselt on igas termodünaamilises protsessis soojushulk Q süsteemi poolt saadud töö võrdub selle tehtud töö pluss selle sisemise energia variatsiooniga. Seetõttu järgneb esimest seadust tähistav võrrand allpool:
Q = τ + ∆U
Nagu öeldud esimeses lõigus, peame seda tegema seal, kus öeldakse, et tööd pole τ=0. Seega on keskkonnaga vahetatav soojus võrdne süsteemi siseenergia suurenemisega. Seega on meil:
Ärge lõpetage kohe... Peale reklaami on veel;)
Q = ∆U
Kui süsteemile antakse soojus, see tähendab, millal Q on positiivne, siseenergia suureneb; ja kui süsteem kaotab soojuse, see tähendab, millal Q on negatiivne, sisemine energia väheneb. Pideva mahuga protsessid toimuvad siis, kui materjali sisaldav anum on jäik (nt gaasiballoon).
Soojuse vastuvõtmisel kipub süsteem laienema, kuid anuma seinad takistavad seda, seega suureneb süsteemi rõhk ja temperatuur.
Autor Domitiano Marques
Lõpetanud füüsika
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
SILVA, Domitiano Correa Marques da. "Esimene seadus isovolumetriliste protsesside jaoks"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isovolumetricos.htm. Juurdepääs 27. juunil 2021.