La electrólisis del agua consiste en la descomposición de esta sustancia mediante una corriente eléctrica y la adición de un electrolito. ¿Entendamos mejor cómo sucede esto?
Leer tambien: ¿Qué es la electrólisis?
¿Cómo ocurre la electrólisis del agua?
Las moléculas de agua son capaces de auto-ionizarse, generando iones H+ (o H3O+) y oh-:
H2O ↔ H+ + OH-
o
2 horas2O ↔ H3O+ + OH-
Sin embargo, el agua es un electrolito muy débil y, a pesar de tener estos iones, no puede conducir corriente eléctrica. Así, para realizar su electrólisis, es decir, su descomposición mediante una corriente eléctrica, es necesario añadir un electrolito, un soluto iónico que puede ser una sal, una base o un ácido.

Orden de prioridad para el alta selectiva
Sin embargo, como se explica en el texto Electrólisis acuosa, en este caso, no solo tendremos los iones provenientes del agua, sino también los de la sustancia que se disolvió en ella. En la electrólisis, solo un catión y un anión se descargan en el electrodo, es decir, es un
descarga selectiva siguiendo un orden de prioridad.Así, para que el cátodo y el ánodo que se descargarán sean los del agua, y no los de la sustancia disuelta, es necesario elegir un ácido, una base o una sal cuyos iones se descargan con menos facilidad de los electrodos que los iones en el agua. Para ello, debemos consultar la cola de prioridad que se muestra a continuación:
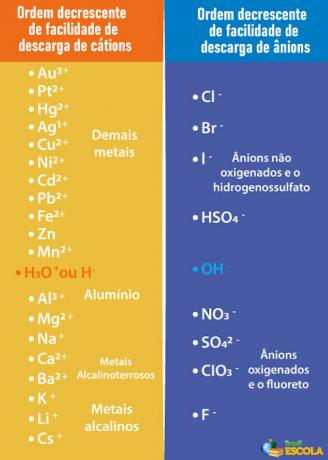
Tenga en cuenta que los cationes enumerados debajo de la H+ tienen menos facilidad de descarga que él. En la tabla de la derecha, vemos que los aniones debajo del OH- tienen menos facilidad de descarga. Por tanto, podemos elegir, por ejemplo, una sal, una base o un ácido que forme los iones de Na.+, K+, EN EL3-, SOLO42- y así sucesivamente, además de formar también los mismos iones que el agua, es decir, H+ y oh-. Algunos ejemplos son: ácido sulfúrico (H2SOLO4), hidróxido de sodio (NaOH) y nitrato de potasio (KNO3).
No pares ahora... Hay más después de la publicidad;)
Ejemplo con las reacciones que ocurrieron en la electrólisis del agua.
Digamos que se realiza una electrólisis del agua con la adición de ácido sulfúrico. En este caso, tendremos la formación de los siguientes iones en el medio:
Disociación ácida: 1 H2SOLO4 → 2 H+ + 1 SO42-
Autoionización del agua: H2O → H+ + OH- o 2 horas2O → H3O+ + OH-
Tenga en cuenta que el único catión existente es H.+, por lo que es él quien sufrirá reducción (ganancia de electrones) en el electrodo negativo (cátodo) y producirá gas hidrógenoO (H2).
Ahora, hablando de aniones, hay dos aniones en el medio, que son el SO42- y el oh-. Como muestra la tabla anterior, el sistema operativo42- es más reactivo y menos fácil de descargar. Por lo tanto, el OH- se descargará, se oxidará (perderá electrones) en el electrodo positivo (ánodo) y producirá gas oxígeno(O2):
Semirreacción del cátodo: 4 H3O+ + 4 y- → H2O + H2
Semirreacción del ánodo: 4 OH- → 2 H2O + 1 O2 + 4 y-
Sumando todo este proceso, llegamos a la ecuación global:
Ionización del agua: 8 H2O → 4 H3O+ + 4 OH-
Semirreacción del cátodo: 4 H3O+ + 4 y- → 4 H2O + 2 H2
Semirreacción del ánodo: 4 OH- → 2 H2O + 1 O2 + 4 y-
Ecuación global: 2H2O → 2 H2 + 1 O2
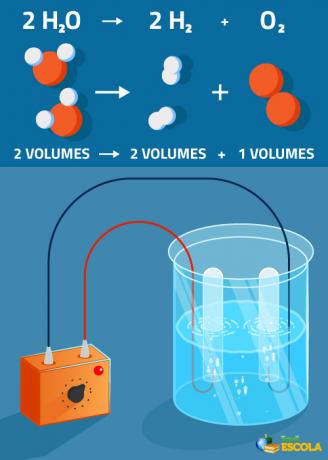
Tenga en cuenta que el volumen de hidrógeno producido es el doble que el del oxígeno. Sin embargo, en la práctica, esta relación estricta no se verifica porque el oxígeno es más soluble que el gas. hidrógeno.
Lea también: Obtención de aluminio mediante electrólisis
Aplicaciones de la electrólisis del agua.
La electrólisis del agua es un proceso muy importante, considerando que el hidrógeno es un gas que se puede utilizar como combustible. Como el combustibles derivados del petróleo no son renovables, el gas hidrógeno podría convertirse en una alternativa importante.
Además, ya existen métodos de producción de gasolina que utilizan el proceso de electrólisis del agua. Mira cómo se hace esto en el texto. Los científicos pueden transformar el dióxido de carbono en gasolina.
Por Jennifer Fogaça
Profesor de química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Electrólisis del agua"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/eletrolise-agua.htm. Consultado el 28 de junio de 2021.
Química

Aplicaciones de electrólisis, galvanoplastia, niquelado, cromado, níquel, cromo, cátodo, sodio, aluminio, cloro, sosa cáustica, gas hidrógeno, electrólisis ígnea, electrólisis acuosa, metales alcalinos, alcalinotérreos, gas cloro.
Química

Electrólisis, soluciones de electrolitos, corriente eléctrica, reacciones de oxidación-reducción, proceso químico espontáneo, proceso químico no espontáneo, transformador, transformación artificial, industrias, metales alcalinos, alcalinotérreos, gas hidrógeno, gas cl


