Por lo general, las reacciones de electrólisis acuosa y electrólisis ígnea se realizan con electrodos de grafito y platino, que no participan en la reacción; solo conducen corriente eléctrica. Sin embargo, hay algunos casos específicos en los que es necesario utilizar electrodos activos, es decir, que sufren reducción y oxidación.
Los principales casos de uso de estos electrodos que participan en el proceso redox son: a purificación electrolítica de metales, tales como zinc, cobalto, níquel y, principalmente, cobre; y tambien el galvanoplastia. Veamos cómo ocurre cada caso:
• Purificación electrolítica de cobre: esta refinación de cobre electrolítico puede producir una pureza de aproximadamente el 99,9% y se utiliza principalmente para hacer alambres de cobre que, si tienen la menor cantidad de impurezas, pueden tener la capacidad de conducir una corriente muy eléctrica disminuido.
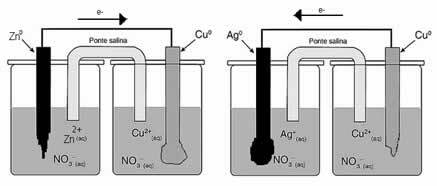
Observe cómo se lleva a cabo este proceso, viendo el esquema de una tina electrolítica ensamblada a continuación:

Se aplica una diferencia de potencial a la solución acuosa de sulfato de cobre (CuSo4 (aq)) - que conduce la electricidad - por lo que el ánodo, que es un cobre metálico impuro, pierde electrones, es decir, se oxida, liberando sus cationes (Cu2+), que se depositan en la placa negativa. Puede ser una placa de platino inerte o, mejor, una placa de cobre puro. Constituye el cátodo, que se reduce a medida que se deposita cobre en él. Así, las semirreacciones que ocurren en los electrodos son:
No pares ahora... Hay más después de la publicidad;)
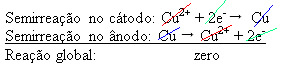
El hecho de que diera un resultado cero indica que no hubo reacción química, sino solo transporte de cobre. En el fondo del recipiente se encuentran las otras sustancias impuras que se encontraban en el cobre como el oro, la plata, la sílice (arena) y otros minerales, que incluso se pueden vender.
• Galvanoplastia: se aplica un revestimiento metálico a un material que debe protegerse de la corrosión.
El metal elegido para el revestimiento, que puede ser cromo (cromo), níquel (níquel), plata (plata), oro (dorado) o zinc (galvanización): será el ánodo, electrodo positivo, que se oxida y pierde electrones. Sufre oxidación en lugar del material que se ha protegido, porque su potencial de reducción es mayor.
El electrodo negativo, es decir, el cátodo, que recibe estos electrones y sufre una reducción, es el propio material que se recubre. De esta manera, permanece protegido incluso si su superficie se viola de alguna manera.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Electrólisis con electrodos activos"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm. Consultado el 28 de junio de 2021.