LA ecuación de clapeyron es una expresión matemática que relaciona cantidades como presión (P), volumen (V), temperatura (T) y el número de partículas (n) que componen una gas perfecto o ideal. Esta ecuación lleva el nombre del físico francés Paulemileclapeyron y puede entenderse como una generalización de las leyes empíricas del gasesPerfectoenGay-Lussac, Charles y Boyle. Fue fundamental para el estudio de los gases ideales y permitió la evolución de Máquinas térmicas, haciéndolos cada vez más eficientes en las últimas décadas.
Vea también: Descubrimientos físicos que ocurrieron por accidente
Ecuación de Clapeyron: ley de los gases ideales
La ecuación de Clapeyron es derivado de tres leyes empíricas, es decir, leyes que se determinaron a partir de experimentos. Tales leyes explican el comportamiento de los gases en transformaciones de gasisovolumétrico (Ley de Gay-Lussac), isobárico (Ley de Charles) y isotermas (Ley de Boyle). Según estas leyes:
en las transformaciones isovolumétrico, la relación entre la presión y la temperatura termodinámica de un gas ideal permanece constante;
en las transformaciones isobárico la relación entre el volumen y la temperatura termodinámica de un gas ideal es constante;
- en las transformaciones isotermas, el producto de la presión y el volumen de un gas ideal permanece constante.
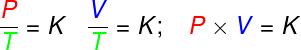
PAG - presión (Pa - pascal)
V - volumen de gas (m³)
T - temperatura termodinámica del gas (K - kelvin)
De las tres leyes anteriores, la ecuación de Clapeyron determina cuál es el valor de este constante (K) obtenido en cada una de las transformaciones antes mencionadas. Según la ecuación de Clapeyron, esta constante es igual al número de moles multiplicado por un constante R, conocida como la constante universal de los gases ideales, e igual a Constante de Boltzmann multiplicado por El número de Avogadro.
Fórmula
Mira la fórmula que se conoce como ecuaciónenClapeyron:
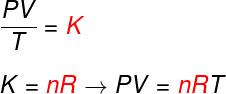
No - número de moles (mol)
R - constante universal de gases ideales (R = 0.082 atm.l / mol. K o 8,314 J. mol / K)
Analizando la ecuación de Clapeyron, es posible ver que la presión ejercida por los gases ideales es directamente proporcional a la temperatura y tambien a número de lunares. Además, la presión es inversamente proporcional al volumen ocupado por gas.
O modelo de gas ideal posible gracias a la ecuación de Clapeyron se utiliza ampliamente para la desarrollo de máquinas impulsadas por fluidos, como máquinas de vapor y motores de combustión interna.
Se pueden obtener varios resultados importantes a partir de la ecuación de Clapeyron. Uno de ellos, por ejemplo, predice que 1 mol de cualquier gas ideal ocupa un volumen de 22,4 litros cuando se somete a la presión de 1 atm (1,01.105 Pa) y a la temperatura de 273K (0 ° C).
Vea también: Conceptos más importantes en termología
Ejercicios resueltos sobre la ecuación de Clapeyron
Pregunta 1 - (UECE) Un gas que puede tener su temperatura, volumen y presión relacionados por PV = nRT tiene las siguientes características:
a) distancia promedio muy grande entre moléculas para descartar interacciones intermoleculares, excepto cuando chocan; las moléculas sufren colisiones elásticas.
b) distancia media muy pequeña entre moléculas; las moléculas sufren colisiones inelásticas.
c) distancia media muy grande entre moléculas para descartar interacciones intermoleculares, excepto cuando chocan; las moléculas sufren colisiones inelásticas.
d) distancia media muy grande entre moléculas y con fuertes interacciones intermoleculares; las moléculas sufren colisiones elásticas.
Resolución:
En el modelo de gas ideal, una gran cantidad de partículas adimensionales se mueven a gran velocidad en direcciones aleatorias. La única interacción que sufren estas partículas son las colisiones perfectamente elásticas, por lo que la alternativa correcta es letra a.
Pregunta 2 - (UFRGS) Considere las siguientes afirmaciones sobre los gases ideales.
I. La constante R presente en la ecuación de estado para gases pV = nRT tiene el mismo valor para todos los gases ideales.
II. Los mismos volúmenes de diferentes gases ideales, a la misma temperatura y presión, contienen el mismo número de moléculas.
III. La energía cinética promedio de las moléculas de un gas ideal es directamente proporcional a la temperatura absoluta del gas.
¿Cuáles son las correctas?
a) Solo yo
b) Solo II
c) Solo III
d) Solo I y II
e) I, II y III
Plantilla:
Veamos las alternativas:
I. correcto, de ahí que se le llame la constante universal de los gases ideales.
II. correcto. Según la ecuación de Clapeyron, si dos gases ideales tienen la misma presión, temperatura y volumen, entonces el número de partículas en esos gases es igual.
III. correcto. Según el teorema de equipartición de energía, la energía cinética de las partículas en un gas ideal es proporcional a su temperatura.
Por tanto, la alternativa correcta es la letra e.
Pregunta 3 - (UFJFHombres como Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, entre otros, han desarrollado importantes estudios sobre las propiedades de los gases. El comportamiento de los gases reales se aproxima a los gases ideales en condiciones de baja presión, así como a los gases contenidos en un gran volumen y a los gases mantenidos a altas temperaturas. Considere que, en un experimento de laboratorio, un recipiente de volumen V completamente cerrado y que contiene 1 mol de un gas ideal a una presión de 4.0 atm se somete a una expansión a una temperatura constante igual a 127 ° C y que el comportamiento de este gas es el de un gas ideal, como se muestra en gráfico.
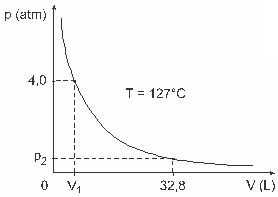
En este caso, cuando el gas esté ocupando un volumen igual a 32,8 L, la presión que ejercerá será:
(Dado: la constante universal de los gases perfectos es R = 0.082 atm. L / mol. K.)
a) 0.32 atm
b) 0.40 atm
c) 1.0 atm
d) 2,0 atmósferas
e) 2,6 atmósferas
Resolución:
Letra C.
Para resolver el ejercicio, necesitamos aplicar los datos a la ecuación de Clapeyron, pero antes necesitamos transformar la temperatura, que está en grados Celsius, a kelvin. Verificar:

Por Rafael Hellerbock
Profesor de física
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm