O ácido sulfúrico es un líquido incoloro, viscoso, de baja volatilidad (temperatura de ebullición: 338 ° C) y extremadamente soluble en agua. Y el sustancia más utilizada por industrias, teniendo amplia aplicación en los más variados procesos.
Lea también: que es la solubilidad?
Fórmula
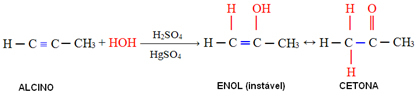
O ácido sulfúrico es un compuesto inorgánico y covalente con fórmula molecularH2SOLO4. Cuando se agrega al agua, libera el catión H+ y el anión sulfato (SO42-), según la siguiente ecuación química:
H2SOLO4 (aq) → 2 H+(aquí) + SO42-(aquí)
Esta disolución es muy exotérmico, es decir, libera una gran cantidad de calor y por tanto requiere cierto cuidado durante el proceso. Para evitar accidentes, siempre ponemos ácido sulfúrico en el aguay nunca al revés, para que el calor liberado se pueda disipar de forma más segura.
Vea también: Química Inorgánica

aplicaciones
La mayor parte del ácido sulfúrico producido en todo el mundo se utiliza para fabricación de fertilizantes fosfatados y sulfatos
. Para esta y otras aplicaciones, el ácido sulfúrico se ha convertido en la sustancia más utilizada por las industrias y puede ser visto como un índice para evaluar el desarrollo industrial de un país.
El ácido sulfúrico también se usa ampliamente en producción de sulfato de aluminio, uno de los productos necesarios para la producción de papel. Este proceso tiene lugar a través de la reacción entre el ácido sulfúrico y el óxido de aluminio presente en el mineral de bauxita:
3 horas2SOLO4 + Al2O3 → Al2(SOLO4)3 + 3 H2O
El ácido sulfúrico también está presente en baterías de plomo utilizadas en automóviles, actuando como electrolito en el proceso de producción de energia electrica.
No pares ahora... Hay más después de la publicidad;)
Sepa mas: Abonos orgánicos e inorgánicos
Como se mencionó, el ácido sulfúrico tiene muchas aplicaciones. Además de los mencionados, enumeraremos otros a continuación:
- Refinando el Petróleo;
- Fabricación de nailon;
- Preparación de superficies de metales en industrias metalúrgicas;
- Catalizador ácido en reacciones químicas;
- Fabricación de explosivos;
- Tratamiento de aguas residuales;
- Desatascar tuberías (en algunos casos).
Lea también: Nitratos, sales muy presentes en explosivos y fertilizantes
donde se encuentra
Debido a su alta solubilidad en agua, el ácido sulfúrico no se encuentra naturalmente en su forma pura. En forma diluida, se puede encontrar en lluvia ácida es en cursos de agua de fuentes minerales, generalmente de sulfuro de hierro.
En la industria, el ácido sulfúrico se produce a base de azufre elemental, por un método llamado proceso de contacto, que sucede en tres pasos:
1er paso: quema de azufre para producir dióxido de azufre.
s(s) + O2 (g) → SO2 (g)
2ª etapa: oxidación del dióxido de azufre a trióxido de azufre.
2 ASÍ2 (g) + O2 (g) → 2 SO3 (g)
3er paso: se hidrata el trióxido de azufre formado, formando ácido sulfúrico.
SOLO3 (g) + H2O(1) → H2SOLO4 (1)
Vea también: que es la lluvia ácida?
Por Victor Ferreira
Profesor de química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FERREIRA, Víctor Ricardo. "Uso de ácido sulfúrico por la industria"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/uso-Acido-sulfurico-pela-industria.htm. Consultado el 28 de junio de 2021.