LA puente de sal fue propuesto por el químico inglés Frederic Daniell, en 1836, cuando este erudito estableció el batería nombrado por él (Danill's Pile). este puente es un tubo en forma de U que tiene dos extremos porosos. (que consiste en algodón o agar-agar) y contiene una solución acuosa formada por agua y una sal. Conecta indirectamente las soluciones de las dos medias celdas de la celda (el ánodo y el cátodo).
Observación: El ánodo es el polo negativo de la batería y es donde se produce la oxidación, y el cátodo es el polo positivo y donde se produce la reducción.
Para comprender la importancia del puente de sal, inicialmente es necesario comprender el funcionamiento del pilote. Vea el diagrama a continuación:
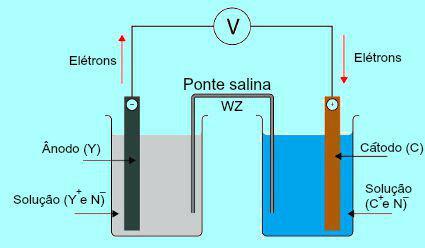
Esquema general de una pila Daniell
Inicialmente, el metal (Y) de la placa presente en el ánodo sufre oxidación. Cuando se oxida, el metal se convierte en catión, que cae en la solución en la que se encuentra la placa. Por esta razón, la solución del ánodo comienza a presentar una mayor concentración de cationes (Y
+). En este caso, se observa una disminución en la placa de metal del ánodo.
Y → y- + Y+
Luego, los electrones perdidos durante la oxidación del metal de la placa del ánodo viajan a través del cable eléctrico externo y van a la placa de metal presente en el cátodo. Por lo tanto, la placa presente en el cátodo se carga con electrones.
-
Los cationes presentes (C+) en la solución se mueven hacia la placa del cátodo porque está cargada con electrones. Los cationes, al ganar los electrones presentes en la placa, se vuelven neutros (estables y sólidos) y se adhieren a ella. Por este motivo, la solución catódica presenta una mayor concentración de aniones que de cationes. En este caso, se observa un aumento de tamaño de la placa de metal del cátodo.
No pares ahora... Hay más después de la publicidad;)
C+ + y- → C
Desde la comprensión de cómo el Pila de Daniell, se puede observar que la solución presente en el ánodo recibe una mayor cantidad de cationes Y+ debido a la oxidación del metal de la placa X. La solución presente en el cátodo, por otro lado, pierde sus cationes (C+) porque sufren una reducción de la placa.
Precisamente sobre este tema se destaca la obra del puente de sal. La función principal de este puente es promover el equilibrio de cargas presentes en las soluciones de ánodo y cátodo. En el puente de sal, siempre tenemos una sal (normalmente cloruro de potasio o nitrato de amonio) disociada en agua. Vea la representación de una ecuación en el puente de sal:
WZ + H2O → W+ + Z-
En el puente de sal, hay dos iones (W+ y Z-), que se desplazan al cátodo y al ánodo de acuerdo con:
La) El ánodo recibe los aniones (Z-) presentes en el puente salino debido a la oxidación del elemento (Y), lo que provoca un aumento en la cantidad de cationes (Y+) en la solución.
B) El cátodo recibe cationes (W+) del puente de sal porque, durante el funcionamiento con batería, el catión (C+) presente en la solución se reduce en el tablero. Así, la solución de cátodo tiene una mayor cantidad de aniones (N-) y por tanto recibe el catión presente en el puente salino.
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "Puente de vela"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Consultado el 28 de junio de 2021.
