Calorlatente es la cantidad de energíatérmico que es absorbido o abandonado por un cuerpo o sistema termodinámico, durante un cambio en su estado físico, en temperatura constante.
Cuando una sustancia pura alcanza su temperatura de Fusión o hirviendo, durante su calentamiento, su estado físico comienza a cambiar. En el proceso, continúa absorbiendo calor, sin embargo, su temperaturarestosconstante. Esto sucede porque, al alcanzar estas temperaturas, en las que se producen cambios de estado físico, todo el calor que está siendo absorbido por el sistema termodinámico se utiliza para superar la energíapotencial que mantiene unidas sus moléculas. Tan pronto como el sistema termodinámico absorbe toda la energía necesaria para romper sus moléculas, la interacción entre ellas disminuye, lo que indica que su estado de agregación ha cambiado. Después del cambio de estado físico, el calor que se absorbió isotermicamente sigue siendo absorbido por las moléculas, proporcionándoles energíacinética. Este tipo de calor que aumenta la energía cinética de las moléculas se llama calor sensible.
veaademás: Siete consejos "de oro" para un estudio de física más eficaz
O calorlatente mide la cantidad de calor, por unidad de masa, necesaria para cualquier cambio en estado físico del cuerpo, por tanto, su unidad de medida, según el Sistema Internacional (SI), es el Jouleporkilogramo (J / kg). Sin embargo, el uso de otras unidades como el caloríaporgramo (cal / g), es bastante común en el estudio de la calorimetría.
Tipos de calor latente
Hay dos tipos de calor: o calorSinivel es el calorlatente. El calor sensible es el que se transfiere entre los cuerpos cuando hay cambios de temperatura. El calor latente, a su vez, ocurre cuando hay transferencias de calor sin cambios de temperatura.
El calor latente se altera por diferentes cambios en el estado físico. Consulta los diferentes tipos de calor latente:
calor latenteenfusión (LF): es el calor que es absorbido o cedido por los cuerpos durante el proceso de fusión: de líquido a sólido y viceversa, con temperatura constante.
calor latenteenvaporización (LV): es el que se transfiere durante las transformaciones sólido-líquido o líquido-sólido, en temperatura constante.
veaademás: ¿Qué es la capacidad térmica?
Ejemplos deencalorlatente
Vea algunas situaciones cotidianas en las que hay intercambios de calor latentes:
Cuando calentamos el agua, hasta una temperatura de 100 ° C, se inicia el proceso de evaporación. Mientras toda el agua no se convierta en vapor, su temperatura no cambia.
Cuando echamos agua sobre una superficie muy caliente, toda el agua se vaporiza casi instantáneamente. Este proceso se llama calentamiento e implica la absorción de calor latente.
Hay intercambio de calor latente cuando tocamos una botella de refresco a bajas temperaturas y todo su contenido se congela rápidamente a temperatura constante, gracias a su temperatura más baja que el punto de fusión del agua.
fórmula de calor latente
El calor latente se calcula por la relación de la cantidad de calor transferido en la transformación isotérmica:
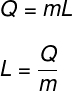
Q - cantidad de calor transferido
metro - masa corporal
L - calor latente
Cambios de fase y calor latente
Se producen cambios de fase en sustancias puras. entemperaturaconstante, a través de la absorción o liberación de calor latente. Todas las sustancias puras tienen un curva de calentamiento similar a la imagen de abajo:
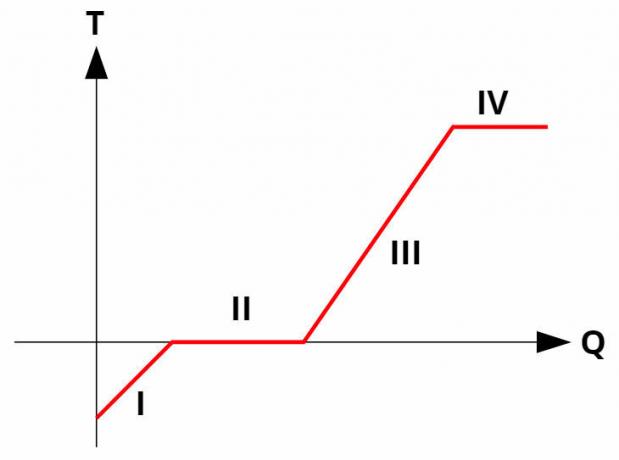
A curvasencalefacción relacionan la temperatura (eje y) con la cantidad de calor dado o recibido (eje x). En los cambios de fase (procesos II y IV), la temperatura permanece constante, aunque todavía hay intercambio de calor.
Vea también: Fundamentos de calorimetría
mesa de calor latente
En condiciones normales de temperatura y presión, O calorlatente de agua, por sus diferentes cambios en el estado físico, se muestra en la siguiente tabla:
Transformación |
Calor latente (cal / g) |
Fusión (0 ° C) |
80 |
Solidificación (0 ° C) |
-80 |
Vaporización (100 ° C) |
540 |
Condensación (100 ° C) |
-540 |
Según la tabla que se muestra arriba, 80calorías congelar 1 gramode agua a la temperatura de fusión (0 ° C). Los signos negativos en el procesos de solidificación y condensación indican que se liberó calor en ellos, por lo que estas dos transformaciones son exotérmico. La siguiente tabla muestra el calor latente en J / kg, para los mismos procesos:
Transformación |
Calor latente (J / kg) |
Fusión (0 ° C) |
333.103 |
Solidificación (0 ° C) |
-333.103 |
Vaporización (100 ° C) |
2,2.106 |
Condensación (100 ° C) |
-2,2.106 |

ejercicios de calor latente
1) Un recipiente contiene 500 g de agua líquida. Sin cambios en la temperatura del agua, todo su contenido se evapora repentinamente. Determine cuánto calor se ha transferido al contenido de este recipiente.
Datos: LF = 540 cal / g
Resolución:
Para calcular la cantidad de calor necesaria para evaporar esta masa de agua, usaremos la siguiente fórmula:
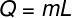
Utilizando los datos proporcionados por el ejercicio, haremos el siguiente cálculo:
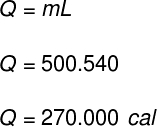
Por mí. Rafael Helerbrock

