Ácidos son sustancias que ionizar en medio acuoso y son buenos conductores de energía. La acidez de una sustancia se puede medir mediante técnicas para medir el potencial iónico de hidrógeno (pH) de una solución. Algunos métodos analíticos de pH utilizan indicadores como tornasol o fenolftaleína, que reflejan el valor del pH de la solución en color.
Los ácidos se pueden caracterizar:
por la presencia o no de oxígeno en su molécula;
por la fuerza;
por hidrógenos ionizables;
por su volatilidad.
Lea también:Comparación entre ácidos y bases: diferencias y propiedades
Características de los ácidos
Se ionizan en un medio acuoso, liberando el catión H+.
Son conductores de electricidad debido a la liberación de iones en un medio acuoso.
En contacto con el medio ambiente básico, sufren reacción de neutralización, formando sal y agua como productos de esta reacción.
Cambian el color de la solución en presencia de una sustancia indicadora como tornasol o fenolftaleína.
El sabor amargo del limón, la naranja, entre otros cítricos, se debe al ácido presente en estos alimentos.
Potencial de hidrógeno (pH)
El potencial de iones de hidrógeno (pH) es un cálculo que expresa la concentración de iones de hidrógeno en cierto solución. Para determinar el pH y analizar el medio se tiene en cuenta lo siguiente:
Ley de dilución de Ostwald (cuanto más diluido, más iones se formarán en la solución);
autoionización de agua (Kw), que es la descomposición natural de la molécula de H2O en iones H+ y oh-;
el agua destilada a 25 ° C tiene autoionización Kw = 10-14 y la misma concentración de iones H+ y oh-, es decir, es un medio neutro.
Para el cálculo de pH con concentración de H+, usar: pH = -log [H+].
Sepa que:
pH> 7 → solución básica
pH <7 → solución ácida
pH = 7 o pH = pOH → solución neutra
Vea también: ¿Cómo son las fórmulas ácidas?

Clasificación de ácidos
LA clasificación ácida se puede hacer teniendo en cuenta cuatro criterios diferentes.
Grado de ionización (α) o fuerza del ácido
α = número de moléculas ionizadas
número de moléculas disueltas
Ácidos fuertes: α ≥ 50%.
Ejemplo: áácido sulfúrico (H2SOLO4) → α = 61%.Ácidos semi-fuertes o moderados: 5% < α < 50%.
Ejemplo: ácido fosfórico (H3POLVO4) → α = 27%.Ácidos débiles: α ≤ 5%.
Ejemplo: ácido bórico (H3BO3) → α = 0,075%.
→ Número de hidrógeno ionizable
monoácido: libera un catión H+.
Ejemplo: áácido clorhídrico (HCL);
diácido: libera dos cationes H+.
Ejemplo: sulfuro de hidrógeno (H2S).Triácido: libera tres cationes H+.
Ejemplo: ácido bórico (H3BO3).tetraácido: libera cuatro cationes H+.
Ejemplo: ácido pirofosfórico (H4PAG2O7).
¡Atención! En el caso de los hidrácidos, todos los hidrógenos de la molécula son ionizables; pero en el caso de los oxiácidos, solo los hidrógenos que están unidos a un átomo de oxígeno son ionizables. Un ejemplo es el ácido hipofosforoso (H3POLVO2), que es un monoácido porque, a pesar de tener tres hidrógenos en su composición, solo libera el hidrógeno que se une al oxígeno.
→ Presencia de oxígeno
oxiácidos: tienen oxígeno en su estructura.
Ejemplo: ácido hipocloroso (HO Cl).
Hidrácidos: no tienen oxígeno en su estructura.
Ejemplo: ácido fluorhídrico (HF).
→ Volatilidad
Reparado: punto de ebullición(PIE) > 100 ° C, cambiando lentamente a un estado gaseoso.
Ejemplo: ácido sulfúrico (H2SOLO4) → PE = 340 ° C.volátiles: punto de ebullición <100 ° C, cambiando rápida y fácilmente a estado gaseoso.
Ejemplo: sulfuro de hidrógeno (H2S) → PE = -59,6 ° C.
Nomenclatura ácida
→ Hidrácidos
Ácido + nombre aniónico + hídrico
Para todos los ácidos, el término "ácido" se utiliza antes de la nomenclatura que caracteriza a la molécula. En hidrácidos, el sufijo "eto" del nombre del elemento se reemplaza por "hídrico".
Ejemplos de:
HCl → ácido clorohídrico
HBr → ácido bromhídrico
HF → ácido flúorhídrico
→ oxiácidos
La nomenclatura de los oxiácidos varía según el número de oxidación (NOX) del elemento central. Vea la tabla a continuación:
NOX del elemento central |
Nomenclatura ácida |
||
prefijo- |
-infijo- |
-sufijo |
|
+1 y +2 |
Hipopótamo- |
-nombre del anión- |
-oso |
+3 y +4 |
-- |
Nombre del anión |
-oso |
+5 y +6 |
-- |
Nombre del anión |
-ic |
+7 |
Por |
-nombre del anión- |
-ic |
Ejemplos:
HClO → Sabiendo que el hidrógeno (H) normalmente tiene NOX +1 y el oxígeno (O) tiene NOX -2, para que tengamos una molécula de carga 0, el cloro (Cl) debe tener NOX +1, por lo que la nomenclatura de este ácido es ácido hipocloroso.
HNO2 → ácido nitroso
HClO4 →áácidoperclórico
→ Excepciones a la regla
H2CO3 → ácido carbónico, y no carbonáceo, como sería bajo la regla de NOX.
H3BO3 → áácido bórico, y no aburrido.
Ácidos en la vida cotidiana
Fertilizantes y medicamentos: Ácido fosfórico (H3POLVO4) es ampliamente utilizado en la fabricación de fertilizantes y también como medicamento. Es uno de varios ácidos que se utilizan en el campo farmacéutico.
Frutas cítricas: tienen ácido ascórbico (C6H8O6), También conocido como vitamina C.
Vinagre: tiene en su composición ácido acético (CH3COOH).
- Agua con gas y refrescos: compuesto de ácido carbónico (H2CO3), lo que le da al producto una sensación refrescante.
También acceda a:Papel de los ácidos en los refrescos

ejercicios resueltos
Pregunta 1 - (Enem) El jugo extraído de la col lombarda se puede utilizar como indicador del carácter ácido (pH entre 0 y 7) o básico (pH entre 7 y 14) de diferentes soluciones. Al mezclar un poco de jugo de repollo y la solución, la mezcla comienza a mostrar diferentes colores, según su naturaleza ácida o básica, según la escala a continuación.
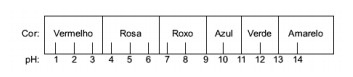
Algunas soluciones fueron probadas con este indicador, produciendo los siguientes resultados:
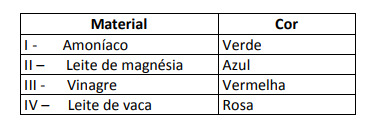
Según estos resultados, las soluciones I, II, III y IV tienen, respectivamente, el siguiente carácter:
A) ácido / básico / básico / ácido.
B) ácido / básico / ácido / básico.
C) básico / ácido / básico / ácido.
D) ácido / ácido / básico / básico.
E) Básico / Básico / Ácido / Ácido.
Resolución
Alternativa E. Para determinar si la sustancia tiene un carácter ácido, básico o incluso neutro, se realiza un análisis de los colores obtenidos en la prueba en relación con los datos de la escala dada. Sabiendo que las soluciones con pH = 7 son neutras, pH> 7 son básicas y con pH <7 son ácidas, llegamos a conclusión de que el amoníaco y la leche de magnesia son sustancias básicas, y el vinagre y la leche de vaca son ácidos.
Pregunta 2 - (PUC-Camp) En cuanto a las sustancias denominadas ácidos, un alumno señaló las siguientes características:
Yo - tengo poder corrosivo;
II - son capaces de neutralizar bases;
III - están compuestos por dos elementos químicos;
IV - forma soluciones acuosas que conducen la corriente eléctrica.
Cometió errores SÓLO en
A) I y II
B) I y III
C) I y IV
D) II y III
E) III y IV
Resolución
Alternativa B. No todos los ácidos son corrosivos, solo los más fuertes, y los ácidos pueden estar compuestos por dos o más átomos.
por Laysa Bernardes
Profesor de química
