Batería es un dispositivo en el que se produce una corriente eléctrica a partir de energía química procedente de un reacción de oxidorreducción, es decir, una especie del reactivo pierde electrones (oxidación), mientras que otra especie gana electrones (reducción).
Vea representaciones de las reacciones de oxidación y reducción que ocurren en cualquier pila:
Oxidación: X → y + X+
La especie X pierde un electrón y se convierte en un catión.
Reducción: Y- + y → Y
el anión Y- gana electrones y se transforma en una especie Y neutra.
Componentes básicos de una pila
Los componentes básicos de una pila son:
Ánodo: electrodo negativo en el que tiene lugar la reacción de oxidación, es decir, pérdida de electrones;
Cátodo: electrodo positivo en el que tiene lugar la reacción de reducción, es decir, ganancia de electrones;
Solución electrolítica (puente de sal) o un material conductor (como una barra de grafito): es el medio por el cual los electrones cedidos por el ánodo llegan al cátodo.
Conceptos básicos de cómo funciona una batería
El funcionamiento de una pila se produce a partir de los siguientes eventos:
1er principio: Oxidación del ánodo
El metal del ánodo, al tener mayor tendencia a perder electrones, se convierte en catión, como observamos en la siguiente ecuación:
Zn → Zn2+ + 2 y
2do Principio: reducción de cátodo
Los cationes que forman parte del material presente en el cátodo (usaremos el cobre como ejemplo), al recibir los electrones del ánodo se transforman en cobre metálico, como podemos ver en la ecuación bramido:
Culo2+ + 2e → Cu
primeras pilas
a) La batería de Alessandro Volta
La pila de respaldo de Alessandro (la primera pila de la historia), ensamblada en 1800, estaba formada por discos de metal intercalados, como en la imagen a continuación:

Montaje similar al Back to your pile de Alessandro
Los discos se intercalaron porque tenían una composición diferente. Uno era de zinc metálico y el otro de cobre, siempre separados por algodón empapado en salmuera (una solución formada por agua y sal).
No pares ahora... Hay más después de la publicidad;)
B) Pila de Daniell
La pila de Daniell, ensamblada en 1836, constaba de dos medias celdas conectadas por un cable conductor y un puente de sal.
Media celda 1: era el ánodo, es decir, el polo negativo de la batería.
Estaba compuesto por una placa de zinc, y una parte de esta placa se sumergió en una solución formada por agua y sulfato de zinc (ZnSO4).
Media celda 2: era el cátodo, es decir, el polo positivo de la batería.
Estaba compuesto por una placa de cobre, y una parte de esta placa se sumergió en una solución formada por agua y sulfato de cobre (CuSO4).
puente de sal
Tubo en forma de U que contenía una solución formada por agua y cloruro de potasio (KCl), que conectaba las dos medias celdas (zinc y cobre) y tenía una lana de vidrio en ambos extremos.
baterías actualmente
Actualmente existen varios modelos de pilas, pero, en general, se ven así:
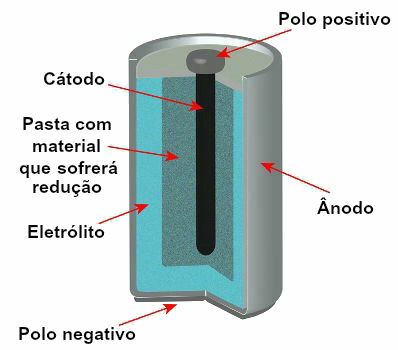
Esquema que representa el modelo de una pila actual
Los modelos más utilizados son la llamada pila Leclanché y la pila alcalina, que tienen las siguientes diferencias:
La) Pila de leclanche
Tiene un ánodo formado por zinc metálico;
Tiene un cátodo formado por una pasta con cloruro de amonio, agua, almidón y dióxido de manganeso;
Tiene una barra de grafito que sirve como conductor de los electrones que parten del cátodo hacia el ánodo.
B) Pila alcalina
Tiene un ánodo formado por zinc metálico o cadmio;
Tiene un cátodo formado por óxido de mercurio, óxido de níquel y yodo;
Debe tener una base mixta en el material que forma el cátodo.
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "¿Qué es una batería?"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm. Consultado el 27 de junio de 2021.