Enzimas son catalizadores biológicos responsables de incrementar la velocidad de una determinada reacción química. Las enzimas suelen ser proteinas, pero hay algunos ácidos ribonucleicos que actúan como enzimas, llamándose ribozimas.
Para acelerar una reacción, las enzimas deben unirse a los reactivos, que se conocen como sustratos. Durante mucho tiempo, se creyó que este vínculo ocurría de una manera muy rígida, un patrón conocido como bloqueo de teclas. en este momento, sin embargo, Se acepta el modelo conocido como ajuste inducido., que asume que ocurren cambios leves en la forma de la enzima cuando el sustrato ingresa al sitio activo.
Lea también: ¿Qué es el metabolismo?
¿Qué son las enzimas?
Las enzimas son biomoléculas que actúan como catalizadores, es decir, son sustancias capaces de acelerar la velocidad de reacciones químicas que ocurren en los seres vivos sin ser consumidos durante estas reacciones. Sin la acción de las enzimas, algunas reacciones serían muy lentas, lo que dañaría el metabolismo. Las enzimas aceleran selectivamente las reacciones y, por tanto, son catalizadores muy específicos.
Las enzimas pueden acelerar una reacción al disminuir la energía de activación, es decir, reducen la cantidad de energía que debe agregarse para que comience una reacción.
[publicación_omnia]
¿Cada enzima es una proteína?
Aunque a menudo se definen como catalizadores biológicos de naturaleza proteica, no todas las enzimas son proteínas. Hay algunos ARN que funcionan como enzimas, llamadas ribozimas. La mayoría de las enzimas, sin embargo, son proteínas y, por tanto, están formadas por aminoácidos. La composición de aminoácidos de estas biomoléculas define la estructura tridimensional que adquirirá.
Lea también: ¿Cómo funcionan las sustancias catalizadoras?
Complejo enzimático-sustrato
Se llama sustrato reactivo sobre el que actúa una enzima. Cuando una enzima se une a su sustrato, el complejo se forma sustrato enzimático. Esta unión tiene lugar en una región específica, llamada sitio activo.
Cuando hablamos de enzimas proteicas, el sitio activo corresponde a unos pocos aminoácidos, siendo el resto de la molécula responsable de determinar la configuración del sitio activo. La forma del sitio activo así como la forma del sustrato están relacionadas con la especificidad de la enzima, ya que deben ser complementarias.
Modelo con cerradura de llave
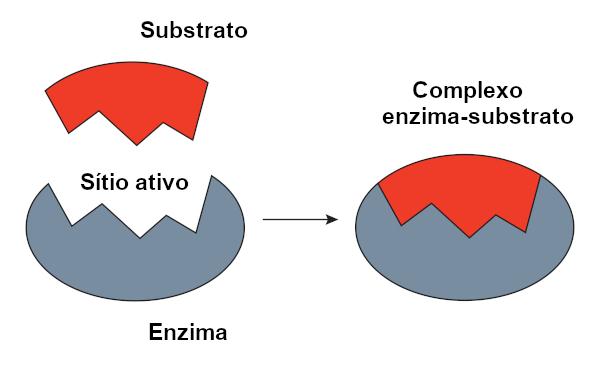
O modelo de cerradura de llave, propuesto por Emil Fischer, se utiliza ampliamente para explicar la interacción entre enzima y sustrato. Según este modelo, existe una complementariedad rígida entre la enzima y el sustrato, como una llave y un candado. El sitio activo de la enzima tendría una forma complementaria al sustrato, que encajaría perfectamente. Otras moléculas, por tanto, no tendrían acceso a este sitio, lo que garantizaría la especificidad de la enzima. Así como una llave abre solo una cerradura, una enzima solo se unirá a un sustrato. Hoy sabemos, sin embargo, que este el modelo no es correcto, ya que las enzimas no son estructuras rígidas como se pensaba anteriormente.
Modelo de ajuste inducido
Actualmente, el modelo más aceptado para explicar el vínculo entre una enzima y su sustrato es el de quebrar inducido, propuesto inicialmente por Koshland et al. El sitio activo y el sustrato no funcionan rígidamente como una llave y un candado. La investigación muestra que a medida que el sustrato ingresa al sitio activo, la enzima sufre una ligera modificación, lo que favorece el ajuste entre el sitio activo y el sustrato. Para comprender mejor este modelo, podemos pensar en la interacción enzima y sustrato como un apretón de manos, que se vuelve más firme después del primer contacto.
Cofactores
La mayoría de las enzimas necesitan moléculas auxiliares para llevar a cabo su acción catalítica, llamadas cofactores. Los cofactores se pueden unir permanentemente a la enzima o se pueden unir débil y reversiblemente al sustrato. Ellos también puede ser inorgánico u orgánico. Cuando los cofactores son moléculas orgánicas, se denominan coenzimas.
Algunas vitaminas actúan como coenzimas, siendo este el caso, por ejemplo, de la riboflavina, también conocida como vitamina B2. Como ejemplos de cofactores inorgánicos, podemos mencionar el hierro y el zinc en su forma iónica.
Lea también: Vitaminas del complejo B: un grupo de vitaminas que generalmente actúan como coenzimas.
Clasificación de enzimas
Las enzimas se pueden clasificar en seis grupos, utilizando como criterio el tipo de reacción que catalizan.
Oxidorreductasas: enzimas relacionadas con las reacciones de oxirreducción.
Transferasas: catalizar la transferencia de grupos de un compuesto a otro.
Hidrolasas: catalizar reacciones de hidrólisis.
Liases: actúan añadiendo grupos a dobles enlaces o eliminando grupos que forman un doble enlace.
Isomerasas: catalizar reacciones de isomerización.
Enlaces: enzimas que provocan la degradación de la molécula de ATP, utilizando la energía liberada en esta reacción para formar nuevos compuestos.
Factores que regulan la actividad enzimática
La actividad de una enzima está influenciada por factores, siendo los principales la temperatura y la pH. La temperatura generalmente juega un papel positivo en las reacciones químicas, aumentando la velocidad de una reacción enzimática. Sin embargo, cuando el temperatura aumenta por encima de las condiciones óptimas, la velocidad de reacción cae considerablemente. Esto se debe a que se observa la desnaturalización de las proteínas. La mayoría de las enzimas humanas tienen una temperatura óptima entre 35 y 40 ºC. Además de la temperatura, la pH también influye en la actividad enzimática, y también hay un valor óptimo. Para la mayoría de las enzimas, el valor de pH óptimo está en el rango de 6 a 8.
Por Vanessa Sardinha dos Santos
Profesor de biologia

