La acción de un catalizador consiste básicamente en acelerar el desarrollo de una determinada reacción. Esto es posible porque el catalizador cambia el mecanismo por el cual procede la reacción, lo que lleva a una "ruta alternativa" que requiere menos energía de activación para que la reacción comience y alcance el complejo activado.
Hay varios tipos de catálisis, uno de los cuales es el catálisis heterogénea, que se puede definir como lo que ocurre cuando el sistema tiene más de una fase, es decir, los reactivos y productos se encuentran en un estado físico diferente al estado físico del catalizador.
Un ejemplo que podemos mencionar es una etapa intermedia de formación de ácido sulfúrico (H2SOLO4 (aq)). Este paso consiste en la formación de trióxido de azufre (SO3 (g)) a través de la reacción de combustión del dióxido de azufre (SO2 (g)):
2 ASÍ2 (g) + O2 (g) → 2 SO3 (g)
Como esta reacción avanza tan lentamente, se usa un catalizador para acelerarla. Un catalizador que se puede utilizar en este caso es el pentóxido de divanadio (V
2O5 (S)), que es sólido. Dado que los reactivos y el producto de reacción son gaseosos, tendremos un sistema heterogéneo.Pero, ¿cómo puede el pentóxido de divanadio acelerar la reacción?
Lo que sucede es que las moléculas del reactivo de oxígeno se adsorben, es decir, se retienen en la superficie del pentóxido de divanadio. Esto provoca que los enlaces de las moléculas de este gas se debiliten con el tiempo, lo que facilita la formación del complejo. activa y, en consecuencia, disminuye la energía de activación de la reacción, aumentando su tasa de desarrollo, es decir, su velocidad.
Vea cómo sucede esto en el diagrama a continuación:
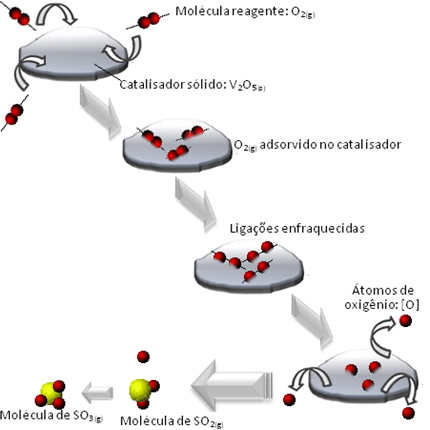
A continuación se muestran otros ejemplos de catálisis heterogénea. Tenga en cuenta que en ambos casos los reactivos y productos están en estado gaseoso, acuoso o líquido, mientras que los catalizadores están en estado sólido:
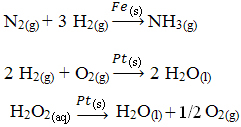
Un ejemplo de catálisis heterogénea que se da en nuestra vida diaria es el de los convertidores. coche catalítico, mejor conocido como catalizadores. Estos dispositivos anticontaminación están recubiertos con sustancias que actúan como catalizadores, siendo generalmente una aleación de paladio y rodio (para motores de gasolina) y paladio y molibdeno (para motores de gasolina). alcohol).
Dentro de este catalizador ocurren reacciones químicas en las que los gases de combustión incompleta, que son más dañinos para los humanos, se convierten en gases no tóxicos. Los reactivos y productos son todos gases, mientras que los catalizadores son sólidos.
Para comprender más sobre el sistema operativo de este equipo, lea el texto: "Conversor catalítico”.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm

