LA energía de activación es la cantidad mínima de energía necesaria para que la colisión entre las partículas de los reactivos, realizada en una orientación favorable, tenga lugar y dé lugar a una reacción.
Las reacciones solo ocurren cuando los reactivos tienen energía de activación (o la energía mínima necesaria, que varía de una reacción a otra; ya sea en cantidad o en forma) o cuando se les suministre.
Por ejemplo, cuando el sodio metálico entra en contacto con el agua, reacciona violentamente. Esto significa que el contenido energético de estos reactivos ya es suficiente para que tenga lugar la reacción.
En el caso de encender una estufa, la reacción de combustión solo ocurrirá si colocamos un fósforo encendido o alguna otra fuente de fuego cerca del gas que está siendo liberado por la estufa. Esto significa que, en este caso, fue necesario suministrar energía al sistema para que alcanzara la energía de activación y se produjera la reacción.
En el caso del propio fósforo utilizado, para que se queme, la energía de activación la proporciona la fricción. Lo mismo ocurre con los encendedores, que también necesitan una chispa que les dé la energía de activación necesaria para la combustión del gas que contienen.
La energía de activación también puede ser proporcionada por la luz, como es el caso de la descomposición del peróxido de hidrógeno. Por eso se almacena en botellas oscuras u opacas.

Por tanto, podemos concluir que la energía de activación (EHasta que) es la diferencia entre la energía necesaria para que comience la reacción (E) y la energía contenida en los reactivos (Epr):

La energía de activación es un obstáculo para que se produzca la reacción y es necesaria para romper los enlaces de los reactivos. Con esto, se produce la reacción y se realizan nuevas conexiones para formar los productos.
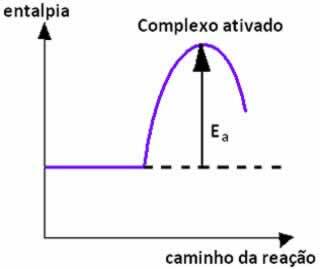
Cuando la colisión entre partículas de reactivos con orientación favorable ocurre con igual o mayor que la energía de activación, antes de la formación de los productos, se forma un estado intermedio e inestable, denominada complejo activado, en el que los enlaces de los reactivos se debilitan y se forman los enlaces del producto. Así, La energía de activación es la energía necesaria para formar el complejo activado.
A continuación tenemos un gráfico que muestra la energía de activación como barrera para que se produzca la reacción:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/energia-ativacao.htm


