O principiodaincertidumbre, también llamado el principio de incertidumbre de Heisenberg, se estableció por primera vez en 1927, por el físico alemán WernerHeisenberg (1901-1976). Este principio indica que no es posible medir, simultaneamente y con precisión, cantidades directamente relacionadas, como velocidad y posición de un cuerpo.
veaademás: Aspectos de la teoría cuántica
Resumen del principio de incertidumbre
El principio de incertidumbre relaciona dos cantidades, como la posición y el momento o la energía y el tiempo, a través del producto de las incertidumbres de las mediciones realizadas sobre ellas.
Según el principio de incertidumbre, cuanto más precisa es la posición de un cuerpo, menos precisa es la medición de su impulso.
El principio de incertidumbre establece que nos es imposible conocer, con total precisión y al mismo tiempo, dos cantidades físicas relacionadas, también llamadas cantidades canónicamente conjugadas.
¿Qué es el principio de incertidumbre de Heisenberg?
O Principio de incertidumbre de Heisenberg
es un resultado teórico extraño obtenido a través de cálculos en el área de Mecánica cuántica, cuya base es exactamente este principio. A través del conocimiento de la Física Clásica, se creía que, conociendo la posición de partida y la velocidad, más específicamente la cantidad de movimiento, de un cuerpo o de un sistema de cuerpos, sería posible predecir su comportamiento en el momentos futuros. De esta forma, sería posible calcular posiciones más tarde, determinando su trayectoria, valores de aceleración,velocidad,energía, etc. Sin embargo, el principio de incertidumbre muestra que incluso si tuviéramos la másnecesario de los instrumentos de medición a mano, no sería posible para nosotros saber, simultaneamente y con precisión, grandeza como posición y La cantidadenmovimiento oenergía y roturaenhora del mismo cuerpo.veaademás: Cantidad de movimiento
Entonces, de acuerdo con ese principio, si podemos determinar el posición de un cuerpo con total precisión, perderemos por completo la medida de su La cantidadenmovimiento, ya que la imprecisión al respecto se considerará infinita. Asimismo, si podemos estar seguros de la cantidad de movimiento de un cuerpo, no será posible conocer su posición.
Lo mismo ocurre con los grandes energía y hora: si sabemos exactamente la cantidad de energía en una partícula, perderemos precisión en las mediciones de tiempo. Del mismo modo, si sabemos cuánto tiempo tardó en ocurrir un evento con una partícula en particular, perderíamos totalmente la información sobre la cantidad de energía presente en ella.

Debido al principio de incertidumbre, es imposible que el nivel de energía más bajo de un cuerpo sea cero.
veaademás: ¿Qué es energía?
No todas las magnitudes físicas están relacionadas entre sí por su grado de precisión. Es posible, por ejemplo, determinar el energía y el posición de una partícula sin que la precisión de estas mediciones sea inversamenteproporcional entre si.
Además, el principio de incertidumbre impone que el producto de las incertidumbres de dos cantidades, como la posición y el momento, siempre será mayor o igual a constante de Planck (h) dividido por 4π. Sin embargo, es común ver la ecuación del principio de incertidumbre escrito en términos de la constante de Planck reducido (? = h / 2π).
Principio de incertidumbre de Heisenberg, que se relaciona con incertidumbredaposición de un cuerpo con el incertidumbre de su impulso, se define mediante la siguiente ecuación:
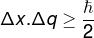
Δx - incertidumbre de posición (m)
q - incertidumbre del impulso (m / s)
? - constante de Planck reducida (1.0545.10−34 J.s)
El principio de incertidumbre también se aplica a la energía y el tiempo de un cuerpo. Mirar:

ΔY -incertidumbre en la energía (J)
t -incertidumbre en el tiempo (s)
Suponga, por ejemplo, que, en un experimento dado, desea medir la posición de un electrón. Para poder medir su posición, es necesario que, de alguna manera, se emita un fotón hacia este electrón. Sin embargo, cuando el fotón se refleja de nuevo al observador, el electrón retrocede, ya que el fotón le transfiere una pequeña cantidad de movimiento directamente proporcional a su frecuencia. Si queremos determinar con mayor precisión la posición de este electrón, podemos aumentar la frecuencia del fotón. Sin embargo, si hacemos esto, aumentaremos la cantidad de movimiento dado al electrón, perdiendo así la precisión en la medición de esta magnitud.
veaademás: ¿Qué es la teoría de cuerdas?
Ejercicio resuelto sobre el principio de incertidumbre
Una medición de laboratorio extremadamente precisa es capaz de determinar la posición de una molécula con incertidumbres en el orden igual a ± 10-15 metro. Según el principio de incertidumbre, ¿cuál es la menor incertidumbre posible al medir el momento de esta molécula?
Resolución
El principio de incertidumbre establece que el producto de las incertidumbres de posición y momento debe ser mayor o igual a la mitad de la constante de Planck reducida:

Por lo tanto, tomando el módulo de la incertidumbre de la posición (Δx = 10-15) proporcionado por el ejercicio y el módulo de constante de Planck reducido (? = 1,0545.10−34 J.s), tendremos que:

El resultado anterior indica que, incluso si el laboratorio tiene algún instrumento capaz de medir la cantidad de movimiento de esta partícula con errores menores a 10-20 metro, no será posible medir su valor con precisión. Por lo tanto, siempre tendremos el valor calculado anteriormente como una desviación más o menos.
Por mí. Rafael Helerbrock
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-principio-incerteza.htm
