Para entender por qué cuando quemamos madera, esta no se derrite, recordemos primero qué es una sustancia fundida, es decir, está en estado líquido.
La diferencia entre los estados sólido, líquido y gaseoso está solo en el estado de agregación de las partículas. En los tres estados, la sustancia está compuesta por las mismas partículas, pero hay más o menos espacio entre ellas.
En estado sólido, las partículas están más juntas, sin mucha libertad de movimiento. En estado líquido, las partículas tienen más libertad y pueden moverse.
Resulta que gran parte de la madera (50%) está hecha de celulosa, que en realidad es un polímero. Un polímero está formado por la unión de varias moléculas, llamadas monómeros. En el caso de la celulosa, está formada por la unión de cientos de moléculas de β-glucosa, como se muestra a continuación. La celulosa tiene entonces la fórmula (C6H10O5)No y alcanza masas moleculares del orden de 400.000 u.
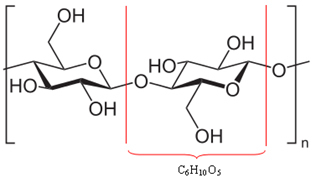
Dado que son moléculas enormes, estos polímeros que componen la madera no pueden moverse con facilidad. Además, tenga en cuenta que las moléculas de β-glucosa que forman la celulosa tienen grupos hidroxilo (─ OH). Estos grupos unen hidrógeno entre sí, que es el tipo más intenso de fuerza intermolecular, manteniendo el polímero firmemente unido.

Enlaces de hidrógeno entre moléculas que componen el polímero de celulosa *
De ese modo, para romper estos lazos, tendríamos que poner tanta energía en el sistema que la madera se descomponga incluso antes de que se derrita y luego deje de ser madera.
Así, cuando se quema, la madera sufre una reacción química, que es más que un simple cambio de estado físico. Sus moléculas terminan por descomponerse y recombinarse con el oxígeno presente en el aire, para luego formar nuevas sustancias, como gas de carbono y agua.

* Fuente y autor de la imagen: laghi.l.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/por-que-madeira-nao-derrete.htm