pasa a transformaciónisocórico cuando una masa dada de un gas sufre cambios en temperatura que desencadenan cambios de presión o viceversa, considerando que la temperatura y presión, en este caso, son cantidades directamente proporcionales, mientras que el volumen del sistema permanece sin cambios.
Vea también: ¿Qué es la presión parcial de los gases?
¿Qué es una transformación isocórica?
Una transformación isocórica es cuando se produce un cambio de temperatura y presión en una masa determinada de gas, pero su volumen sigue siendo el mismo. El cambio de presión será directamente proporcional a la temperatura., es decir, si un gas, en un determinado sistema cerrado, duplica su temperatura absoluta, esto provocará un aumento de presión al doble de lo que era inicialmente.
Este tipo de transformación también se llama isovolumétrico o isométrico. El término isocórico proviene del griego Isokhora, en que Yo asi significa "igual" y khora significa "lugar o volumen" (en este contexto).
Ejemplos:
Los neumáticos de un automóvil experimentan una transformación isocórica, lo podemos observar cuando hacemos su
calibración. En los días calurosos, la presión dada en el monitor de calibración es más alta que en los días fríos. Esto se debe a que, con un aumento de temperatura, la presión aumenta, ya que el volumen permanece.
Otros ejemplos son los desodorantes en aerosol, en este tipo de producto hay una advertencia en la etiqueta de no ser almacenado ni sometido a altas temperaturas, porque, además de que algunas de sus sustancias son inflamables, existe la condición de transformación isocórica o isovolumétrico. Como los desodorantes en aerosol están dentro de una botella sellada y en estado gaseoso, un aumento de temperatura provocará un aumento de la presión y el riesgo de explosión.
Características de una transformación isocórica
- Volumen constante.
- La presión y la temperatura son directamente proporcionales.
Estas características se pueden describir mediante las siguientes fórmulas:

Gráfica de una función isocórica
Tenga en cuenta la siguiente tabla que describe el comportamiento de un gas en relación con la presión, la temperatura y la constante resultante.
Temperatura (° C) |
Presión (atm) |
P / T = constante |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Tenga en cuenta que la presión sigue al aumento de temperatura, por lo que la relación P / T permanece constante, lo que significa que la presión y la temperatura son cantidades directamente proporcionales. Por tanto, el gráfico que describe las transformaciones isocóricas es de tipo lineal. Vea:

¿Quién descubrió la transformación isocórica?
Jacques Alexandre César Charles (1746-1823) fue el científico francés que, estudiando el comportamiento de los gases en un sistema cerrado para la creación de un termómetro de precisión, concluyó los estudios sobre transformaciones isocóricas.
El científico Joseph Louis Gay-Lussac (1778-1850) también desarrolló un estudio sobre la expansión y contracción de un sistema gaseoso. Estos fueron análisis independientes, pero como llegaron a la misma conclusión, dividieron los créditos. Hoy algunos autores se refieren a las dos últimas leyes físicas de los gases que explican la transformaciones isobáricas y como isochoric Primera y segunda leyes de Charles-Gay-Lussac.
Vea también: Ley volumétrica de Gay-Lussac
Ejerciciosresuelto
Pregunta 1 - (PUC-RJ) Un neumático de bicicleta se calibra a una presión de 4 atm, en un día frío, a una temperatura de 7 ° C. El volumen y la cantidad de gas inyectado son los mismos. ¿Cuál será la presión de calibración en el neumático cuando la temperatura alcance los 37 ° C?
a) 21,1 atm
b) 4,4 atmósferas
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Resolución
Alternativa A
1er paso: identificar el sistema y extraer los datos.
Sistema isovolumétrico
P1 = 4 atmósferas
T1 = 7 ° C
T2 = 37 ° C
P2 =?
Usando la fórmula:
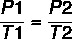
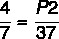
7 x P2 = 37 x 4
P2 = 148/7
P2 = 21,14 atmósferas
Pregunta 2 - (Unifor-CE) Examine la siguiente figura.
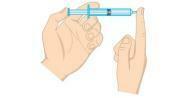
La presión del gas dentro de la jeringa se puede reducir:
a) colocando la jeringa en agua helada, manteniendo el extremo tapado.
b) apretar el émbolo, manteniendo el extremo tapado.
c) colocar la jeringa en agua caliente, manteniendo el extremo tapado.
d) abrir la punta y expulsar la mitad del aire de la jeringa.
e) tirando del émbolo, manteniendo el extremo abierto.
Resolución
Alternativa A. La presión de un gas es directamente proporcional a la temperatura en un sistema isocórico, es decir, sin cambiar el volumen o la masa del gas. Cuando hay una disminución de temperatura, también habrá una caída de presión.
Por Laysa Bernardes Marques de Araujo
Profesor de química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm
