Para que ocurra una reacción química es necesario satisfacer cuatro condiciones básicas, que son:
1. Los reactivos deben contactar;
2. Debe haber afinidad química entre los reactivos;
3. Las colisiones entre partículas de reactivo deben ser efectivas;
4. Debe alcanzarse la energía de activación.
Vea brevemente cada caso:
1.Contacto entre reactivos:
Esta condición es obvia, porque incluso si los reactivos tienen mucha afinidad entre sí, como en el caso de los ácidos y las bases, si se separan, la reacción no ocurrirá. Necesitan entrar en contacto para que sus partículas puedan colisionar, rompiendo los enlaces de los reactivos y formando los enlaces de los productos.

2.Afinidad química:
Como hemos visto, poner en contacto los reactivos es necesario, pero no suficiente. Por ejemplo, si ponemos sodio en contacto con agua, se producirá una reacción extremadamente violenta, pero si ponemos oro, no veremos ninguna diferencia. Esto se debe a que diferentes sustancias tienen diferentes afinidades químicas entre sí, o pueden no tener ninguna afinidad en absoluto. Cuanto mayor sea la afinidad química, más rápida será la reacción.
En los ejemplos mencionados, el sodio tiene una gran afinidad con el agua, tanto que para no entrar en contacto con la humedad del aire, el sodio metálico se almacena en el queroseno. El oro es inerte, razón por la cual los monumentos de oro duran tanto, como los sarcófagos de Egipto.

3.Teoría de colisiones:
Incluso en compuestos que tienen afinidad química, para que se produzca la reacción es necesario que sus partículas, átomos o moléculas choquen eficazmente. No todas las partículas que chocan lo hacen de manera efectiva, pero los choques que resultan en la rotura del Los enlaces reactivos y la formación de nuevos enlaces son aquellos que se producen en la orientación correcta y con la energía. suficiente.
No pares ahora... Hay más después de la publicidad;)
A continuación se muestra el caso de dos colisiones ineficaces y una colisión efectiva que da como resultado que se produzca la reacción.
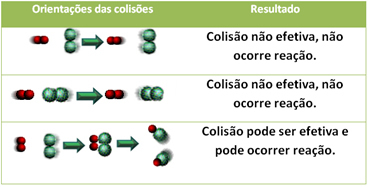
4.Energía de activación y complejo activado:
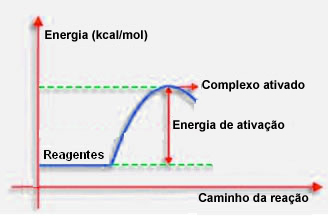
Como se indicó en el ítem anterior, una colisión efectiva, además de una guía favorable, también necesita suficiente energía. La cantidad mínima de energía necesaria para que tenga lugar cada reacción se llama energía de activación.
Si los reactivos tienen una energía igual o mayor que la energía de activación, durante el choque bien orientado, Se formará un complejo inicialmente activado, que es una estructura intermedia entre los reactivos y el productos. En el complejo activado, se debilitan los enlaces de los reactivos y se forman nuevos enlaces de productos.
Así, la energía de activación funciona como una especie de barrera para que ocurra la reacción, porque cuanto más grande sea, más difícil será que ocurra la reacción. En algunos casos, es necesario suministrar energía a los reactivos. Por ejemplo, el gas de cocción tiene afinidad para interactuar con el oxígeno en el aire, pero necesitamos suministrar energía cuando juntamos la cerilla, de lo contrario, la reacción no se produce. Pero una vez iniciada, la reacción en sí misma libera suficiente energía para activar las otras moléculas y mantener la reacción.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Condiciones para la aparición de reacciones químicas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Consultado el 27 de junio de 2021.


