Las celdas o celdas electroquímicas y las baterías son dispositivos en los que la energía química se transforma espontáneamente en energía eléctrica..La celda está compuesta por solo dos electrodos y un electrolito, mientras que la batería es un conjunto de baterías en serie o en paralelo.
A las baterías primarias son dispositivos no recargables, siendo que cuando cesa la reacción de oxidación-reducción que tiene lugar en su interior, deben ser descartados.
Para cada equipo se indica un tipo de batería y, entre las baterías primarias que se utilizan actualmente, las principales son: Pilas secas Leclanché (pilas comunes o pilas ácidas), pilas alcalinas y pilas de litio / dióxido de manganeso.
Vea lo que los distingue y para qué equipos son adecuados:
- Celdas Secas Leclanché:
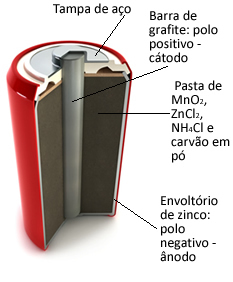
Estos montones están formados básicamente por una envoltura de zinc, separada por un papel poroso y una barra central de grafito rodeada de dióxido de manganeso (MnO2), carbón vegetal en polvo (C) y una pasta húmeda que contiene cloruro de amonio (NH4Cl), cloruro de zinc (ZnCl2) y agua (H2O).
O zinc funciona como el ánodo, perdiendo electrones; es el grafito funciona como el cátodo, que conduce electrones a dióxido de manganeso:
Media reacción del ánodo: Zn (s) → Zn2+(aquí) + 2 y-
Semirreacción del cátodo: 2 MnO2 (aq) + 2 NH41+(aquí) + 2e- → 1 Mn2O3(s) + 2NH3 (g) + 1 hora2O(1)
Reacción global: Zn (s) + 2 MnO2 (aq) + 2 NH41+(aquí) → Zn2+(aquí) + 1 Mn2O3 (s) + 2NH3 (g)
Este tipo de batería es adecuado para equipos que requieren una descarga ligera y continua, como control remoto, reloj de pared, radio portátil y juguetes.
Puede obtener más detalles sobre el origen, funcionamiento, durabilidad, ddp, peligros y precauciones que se deben tomar con estas baterías en el texto “Pila seca Leclanché”.
No pares ahora... Hay más después de la publicidad;)
- Baterías alcalinas:
Su funcionamiento es muy similar al de las pilas secas de Leclanché, sin embargo, la única diferencia es que en lugar de cloruro amonio (que es una sal ácida), se agrega una base fuerte, principalmente hidróxido de sodio (NaOH) o hidróxido de potasio (KOH).
Media reacción del ánodo: Zn + 2 OH → ZnO + H2O + 2e-
Semirreacción del cátodo: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Reacción general: Zn +2 MnO2→ ZnO + Mn 2O3

Las pilas alcalinas son más ventajosas que las ácidas en el sentido de que tienen una mayor durabilidad, en normalmente proporcionan un 50-100% más de energía que una batería normal del mismo tamaño, además de que hay menos peligro de fugas.
Están principalmente indicados para dispositivos que requieren descargas rápidas e intensas, como radios, reproductores portátiles de CD / DVD y MP3, linternas, cámaras digitales, etc.
También lee el texto Baterías alcalinas.
- Baterías de litio / dióxido de manganeso:
Estas baterías son livianas y generan un gran voltaje (aproximadamente 3.4 V), por lo que a menudo se usan en equipos pequeños como relojes y calculadoras. A diferencia de los casos anteriores, su formato es moneda, como se muestra en la siguiente imagen:

El ánodo es de litio, el cátodo es dióxido de manganeso y el electrolito es una solución salina:
Media reacción del ánodo: leer →leer+ + y−
Semirreacción del cátodo: MnO2 + leer+ + y−→MnO2(li)
Reacción general: Li + MnO2 → MnO2(li)
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Tipos más comunes de pilas y baterías primarias"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Consultado el 27 de junio de 2021.


