Uno de los mayores desafíos para cualquiera que esté aprendiendo Química se llama distribución electrónica. Lo que vamos a presentar en este contexto puede facilitar enormemente sus estudios relacionados con la configuración electrónica propuesta por el científico Linus Pauling.
El número máximo de electrones que cabe en cada capa o nivel de energía se da a través de la tabla:
Capa de nivel de energía Número máximo de electrones
1er K 2
2do L 8
3er M 18
4to N 32
5 ° O 32
6º P 18
7mo Q 8
El orden creciente de energía de los subniveles es el orden en la secuencia de las diagonales. El diagrama de Linus Pauling se muestra a continuación:
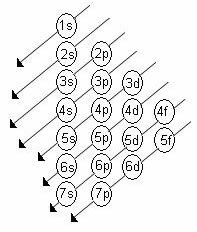
Reglas básicas:
1. El número atómico (Z) del elemento, en estado neutro, indica el número de electrones a distribuir. Este número está representado en la parte inferior izquierda del símbolo del elemento.
2. Usando el diagrama de Pauling, comience a distribuir los electrones de arriba hacia abajo, teniendo en cuenta el orden creciente de energía (orientado por la dirección de las flechas).
3. Llene los subniveles con el nivel máximo de electrones. Si un subnivel determinado solo contiene 6 electrones, no exceda esa cantidad.
4. Verifique la cantidad de electrones sumándolos en cada subnivel.
¿Vamos a ponerlo en práctica?
Distribuye los electrones del átomo de hierro (Z = 26).
Si el número atómico es 26, significa que en el átomo de hierro normal hay 26 electrones. Aplicando el diagrama de Pauling, tendremos:

Por Líria Alves
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
