Entropía es la medida del grado de desorden de un sistema, siendo una medida de la indisponibilidad de energía.
Es una cantidad física que se relaciona con Segunda ley de la termodinámica y que tiende a aumentar de forma natural en el Universo.
Definición de entropía
“Desorden” no debe entenderse como “desorden” sino más bien como una forma de organización del sistema.
El concepto de entropía se aplica a veces en otras áreas del conocimiento con este sentido de desorden, que se acerca más al sentido común.
Por ejemplo, imaginemos tres frascos, uno con pequeñas canicas azules, otro con el mismo tipo de canicas pero rojas y el tercero vacío.
Cogemos la olla vacía y ponemos todas las bolas azules debajo y todas las bolas rojas encima. En este caso, las bolas están separadas y organizadas por colores.
Al agitar la olla, las bolas comenzaron a mezclarse de tal manera que en un momento dado ya no existe la separación inicial.
Incluso si seguimos sacudiendo el bote, es poco probable que las bolas vuelvan a la misma organización inicial. Es decir, el sistema ordenado (bolas separadas por color) se ha convertido en un sistema desordenado (bolas mixtas).

Así, la tendencia natural es aumentar el desorden de un sistema, lo que significa un aumento de la entropía. Entonces podemos decir que en los sistemas: ΔS> 0, donde S es la entropía.
También entiende lo que es entalpía.
Entropía y termodinámica
El concepto de Entropía comenzó a ser desarrollado por el ingeniero e investigador francés Nicolas Sadi Carnot.
En su investigación sobre la transformación de la energía mecánica en térmica, y viceversa, encontró que sería imposible que hubiera una máquina térmica completamente eficiente.
LA Primera ley de la termodinámica básicamente determina que "la energía se conserva". Esto significa que en los procesos físicos la energía no se pierde, se convierte de un tipo a otro.
Por ejemplo, una máquina usa energía para hacer un trabajo y en ese proceso la máquina se calienta. Es decir, la energía mecánica se degrada en energía térmica.
La energía térmica no vuelve a convertirse en energía mecánica (si eso sucediera, la máquina nunca fallaría), por lo que el proceso es irreversible.
Posteriormente, Lord Kelvin complementó la investigación de Carnot sobre la irreversibilidad de los procesos termodinámicos, dando lugar a las bases de Segunda ley de la termodinámica.
Rudolf Clausius fue el primero en utilizar el término Entropía en 1865. La entropía sería la medida de la cantidad de Energía térmica que no se puede invertir en energía mecánica (no puede funcionar) a una determinada temperatura.
Clausius desarrolló la fórmula matemática para la variación de la entropía () S) que se utiliza actualmente.
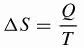
Ser,
ΔS: variación de entropía (J / K)
Q: transferencia de calor (J)
T: temperatura (K)
Leer tambien:
- Termodinámica
- Ciclo de Carnot
- Energía
- Tipos de energía
- Fórmulas de física
Ejercicios resueltos
1) Enem - 2016
Hasta 1824 se creía que los motores térmicos, ejemplos de los cuales son los motores de vapor y los motores de combustión actuales, podrían tener un funcionamiento ideal. Sadi Carnot demostró la imposibilidad de una máquina térmica, operando en ciclos entre dos fuentes térmicas (una caliente y una fría), para obtener una eficiencia del 100%. Tal limitación ocurre porque estas máquinas
a) realizar trabajos mecánicos.
b) producir una mayor entropía.
c) utilizar transformaciones adiabáticas.
d) contravenir la ley de conservación de energía.
e) operar a la misma temperatura que la fuente caliente.
Alternativa: b) producir una mayor entropía.
2) Enem - 2011
Un motor solo puede funcionar si recibe una cantidad de energía de otro sistema. En este caso, la energía almacenada en el combustible se libera, en parte, durante la combustión para que el aparato pueda funcionar. Cuando el motor funciona, parte de la energía convertida o transformada en la combustión no se puede utilizar para trabajar. Esto significa que hay una fuga de energía de otra forma. Carvalho, A. X. Z.
Física Térmica. Belo Horizonte: Pax, 2009 (adaptado).
Según el texto, las transformaciones de energía que ocurren durante el funcionamiento del motor se deben a una
a) la liberación de calor dentro del motor es imposible.
b) el trabajo realizado por el motor es incontrolable.
c) la conversión completa de calor en trabajo es imposible.
d) la transformación de energía térmica en cinética es imposible.
e) el uso potencial de energía del combustible es incontrolable.
Alternativa: c) es imposible la conversión completa de calor en trabajo.
vea también: Ejercicios de termodinámica



