Utilizando una ampolla de Crookes, es decir, tubos de vidrio cerrados con electrodo positivo y negativo, que contienen gases a presiones extremadamente bajas; el científico inglés Joseph John Thomson (1856-1940) hizo un descubrimiento fundamental para la evolución del modelo atómico.
Sometió estos gases a voltajes extremadamente altos, por lo que se pudo observar la aparición de emisiones, las cuales fueron denominadas rayos catódicos. Luego, se colocó un campo eléctrico externo y, finalmente, se comprobó que el haz de rayos catódicos estaba desviado, yendo siempre en la dirección y dirección de la placa cargada positivamente. Por tanto, estas emisiones tuvieron cargas negativas.
Otro punto importante es que no importa qué gas se utilizó, siempre fue el mismo; así Thomson llegó a la conclusión lógica de que estas cargas negativas estaban presentes en todos y cada uno de los asuntos, eran una parte integral del mismo. Así, se demostró que, contrariamente a lo que había dicho Dalton, el átomo no era indivisible, ya que tenía una partícula subatómica negativa, que se denominó
Secuencialmente, en 1886, otro científico, llamado Eugen Goldstein, descubrió la rayos de ánodo o canales, que eran rayos cargados positivamente, formados por lo que quedaba de los átomos del gas cuyos electrones fueron arrancados por la descarga eléctrica. Se sabía que estos rayos poseían Carga positiva porque fueron desviados en la dirección opuesta a los rayos catódicos, es decir, fueron atraídos por la placa negativa.
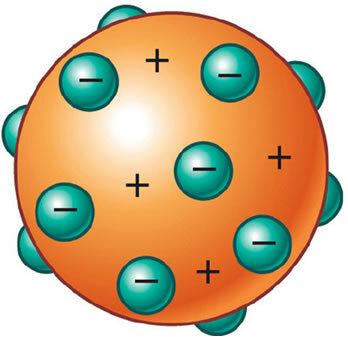
Entonces se descubrió que el átomo también tenía una parte positiva, que incluso era necesaria para mantener su neutralidad eléctrica. Así, J. J. Thomson propuso un nuevo modelo para el átomo, denominado el "pudín de pasas" o "Pudin de ciruela". Sería una esfera no masiva cargada positivamente con incrustaciones de electrones (negativos) de modo que su carga eléctrica total es nula.
Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil
Química General - Química - Escuela Brasil
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/o-experimento-thomson-com-descargas-eletricas.htm
