En laboratorios e industrias químicas es muy importante conocer la cantidad de sustancias involucradas en las reacciones. Por tanto, a continuación trataremos los principales conceptos, cantidades y unidades de medida relacionados con las masas de los átomos:
- Unidad de masa atómica (u):
El átomo de referencia de peso estándar para designar la unidad de masa atómica es el carbono-12 (12C). Una unidad de masa atómica (1 u) corresponde al valor de 1,66054. 10-24 g, que es la masa de 1/12 del isótopo de carbono con una masa igual a 12 (12C).
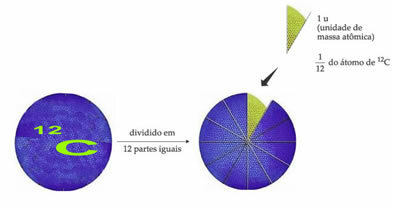
La unidad de masa atómica (u) es la unidad utilizada en todas las cantidades que se enumeran a continuación.
- Masa atómica de un átomo o isótopo (MA):
Se obtiene comparándolo con el valor de referencia mencionado en el ítem anterior. Por ejemplo, la masa atómica de 919F viene dado por el espectrómetro de masas, que es igual a 18.9984 u. Redondeando, es igual a 19, que es el mismo valor que su número de masa (A). Este valor significa que la masa atómica del elemento 919F es 19 veces mayor que la masa de 1/12 del 12C.
- Masa atómica de un elemento (AM):
La masa atómica del elemento está determinada por el promedio ponderado de las masas atómicas de sus isótopos. Esto se hace multiplicando las masas atómicas de cada isótopo por el porcentaje que aparece en la constitución del elemento. A continuación, se suman estos valores, que se dividen por 100, lo que da como resultado el porcentaje total.
Por ejemplo, el elemento neón está compuesto por tres isótopos con las siguientes masas atómicas y porcentajes en su constitución:

Calculando la masa atómica (MA) de este elemento:
MALOneón = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
MALOneón = 20.179 u
- Masa molecular (MM):
Como su nombre lo indica, se utiliza para sustancias moleculares, es decir, átomos enlazados mediante un intercambio de pares de electrones, que se denominan enlaces covalentes.
La masa molecular se obtiene multiplicando el número de átomos de cada elemento por sus masas atómicas y sumando los resultados.
Por ejemplo, la molécula de CO2 contiene un carbono y dos oxígenos, por lo que multiplicaremos la masa atómica del carbono por 1; y oxígeno por dos, agregándolos luego:
MMCO2 = (1. MALOC) + (2. MALOO)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Fórmula de masa:
Sin embargo, es el mismo cálculo realizado para la masa molecular para compuestos iónicos. En este caso el nombre es diferente, porque no se agrupan en moléculas, sino en grupos de iones. Como las moléculas no existen, obviamente no tiene sentido hablar de masa molecular, pero el razonamiento detrás del cálculo es el mismo.
Ejemplo:
NaCl
↓ ↓
23 +35.5 → Fórmula masa = 58.5 u
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm