Según el químico francés Henry Louis Le Chatelier, cambio de equilibrio es una situación en la que una reacción química se desplaza (hacia adelante o hacia atrás) cuando se somete a una perturbación externa. Esta declaración propuesta por el químico se conoció como principio de Le Chatelier.
Nota: La reacción directa es aquella en la que los reactivos se transforman en productos, mientras que la reacción inversa es aquella en la que los productos se transforman en reactivos.
Una reacción está en equilibrio cuando la velocidad de la reacción directa es la misma que la de la reacción inversa, es decir, la los reactivos se convierten en productos al mismo ritmo que los productos se convierten en reactivos.

Representación general de una reacción química en equilibrio.
Según el principio de Le Chatelier, siempre que una fuerza actúa sobre una reacción de equilibrio, la cambio de equilibrio tendrá lugar para anular esta perturbación y establecer una nueva situación de equilibrio en la reacción.
Las perturbaciones capaces de cambiar un equilibrio químico ellos son:
→ variación de concentración
Cuando a concentración en cantidad de materia (en mol / L o molar) de un participante en la reacción cambia (ya sea disminuido o aumentado), la cambio de equilibrio, siempre que ese participante no esté en estado sólido.
Por tanto, de acuerdo con el principio de Le Chatelier, si el concentración si se aumenta un participante, el saldo cambiará en la dirección opuesta al aumento. Sin embargo, si el concentración el participante se reduce, habrá un desplazamiento del saldo en la dirección de la disminución. Por ejemplo:

Representación general de una reacción química en equilibrio.
Aumentando la concentración de A = el equilibrio se desplaza hacia la derecha
Disminuir la concentración de B = el equilibrio se desplaza hacia la izquierda
→ Variación de presión
La variación de presión solo promueve cambio en el equilibrio que tienen componentes gaseosos, ya que cuando aumenta las moléculas aumentan las colisiones entre sí, y cuando disminuye la presión, disminuyen las colisiones entre sí.
Las colisiones entre moléculas aumentan al aumentar presión, porque el volumen (espacio) se reduce en consecuencia, mientras que se reduce el presión se acompaña de un aumento de volumen.
Nota: En un equilibrio químico, el análisis del efecto de la modificación de la presión tiene en cuenta el volumen molar de los reactivos y productos, cuyo volumen está relacionado con los coeficientes de reacción. En la siguiente ecuación, el volumen de reactivo es 4 y el producto es 2.
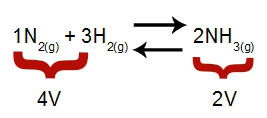
Ecuación que indica los volúmenes presentes en la formación de amoniaco
Según el principio de Le Chatelier, si se aumenta la presión de un sistema, el desplazamiento de la equilibrio en la dirección de mayor volumen, mientras que si se disminuye la presión, el desplazamiento de la equilibrio.

Ecuación que representa el equilibrio de la formación de amoníaco.
Presión creciente = el equilibrio se desplaza hacia la derecha (porque es el lado con menos volumen).
Presión decreciente = el equilibrio se desplaza hacia la izquierda (porque este es el lado de mayor volumen).
→ Variación de temperatura
El aumento en temperatura de una reacción de equilibrio favorece que las moléculas choquen más, mientras que la disminución de temperaturaa disminuye su agitación y, en consecuencia, sus conmociones. Dado que el aumento de temperatura siempre favorece una reacción endotérmico (uno que absorbe energía).
El análisis del efecto de la temperatura sobre un equilibrio tiene en cuenta principalmente el ΔH de la reacción. Si ΔH es positivo, la reacción directa será endotérmica, mientras que la inversa será exotérmica. Si el ΔH es negativo, el de la derecha será exotérmico y el inverso, endotérmico.
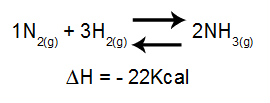
Ecuación que contiene variación de entalpía en la formación de amoníaco
Aumento de la temperatura = el equilibrio se desplaza hacia la izquierda (porque esta es la dirección de la reacción endotérmica, ya que ΔH es negativo).
Disminuir la temperatura = el equilibrio se desplaza hacia la derecha (porque esta es la dirección de la reacción exotérmica, ya que ΔH es negativo).
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm


