En el reacciones de adiciónen alquenos(hidrocarburos que tienen un doble enlace entre dos átomos de carbono), se rompe un enlace pi entre dos carbonos y cada uno de los carbonos se une a un nuevo átomo. Vea:
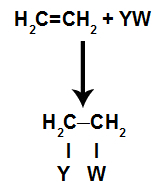
Modelo esquemático general de una reacción de adición.
Principios de una reacción de adición
a) Rotura del enlace pi
Un enlace pi se rompe fácilmente porque es un enlace más débil que un enlace sigma. Sin embargo, para que esto suceda, es necesario que el alqueno esté sometido a condiciones que proporcionen esta alteración. Después de romper el enlace pi entre dos carbonos, siempre aparece un sitio de enlace (para nuevos átomos) en cada uno de los carbonos involucrados.
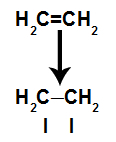
Esquema que representa la rotura del enlace pi
b) Condiciones para romper un enlace pi
Los factores que favorecen la ruptura de un enlace pi son:
Uso de catalizadores;
Calefacción;
Presencia de un ácido en el medio de reacción.
c) La ocurrencia de la reacción de adición.
Los sitios de unión creados después de que se rompe el enlace pi siempre estarán ocupados por átomos del reactivo que está en el mismo contenedor que el alqueno. La reacción de adición lleva el nombre del tipo de reactivo mezclado con el alqueno.
Tipos de reacciones de adición en alquenos
a) Hidrogenación
Un alqueno se mezcla con gas hidrógeno (H2) en un recipiente y sometido a la acción de un catalizador sólido (níquel, platino o paladio) y calentamiento (Δ).
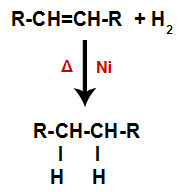
Esquema general de una reacción de hidrogenación en alquenos.
La presencia del catalizador y el calentamiento provocan el enlace pi del alqueno y el enlace sigma entre los hidrógenos de H2 romperse más rápidamente. Con eso, tenemos la creación de dos sitios de enlace en el alqueno y dos átomos de hidrógeno libres en el medio de reacción.

Creación de sitios de unión y separación de átomos.
Así, inmediatamente después, cada átomo de hidrógeno libre ocupa uno de los sitios de enlace formados en el alqueno. Como la sustancia formada solo tiene carbonos e hidrógenos, así como solo enlaces simples entre los carbonos, es una alcano.
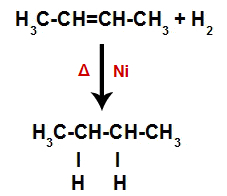
Ecuación que representa la formación de alcano en hidrogenación.
B) Halogenación
Un alqueno se mezcla con sustancias simples (F2, Cl2, br2 Oye2) formado por halógenos (cloro, flúor, yodo y bromo) en un recipiente y sometido a la acción de la luz (λ) y calentamiento (Δ).

Esquema general de una reacción de halogenación en alquenos.
La acción de la luz y el calentamiento hacen que el enlace pi del alqueno y el enlace sigma entre sustancias formadas por halógenos se rompan más rápidamente. Con esto, tenemos la creación de dos sitios de unión en el alqueno y dos átomos de halógeno libres en el medio de reacción.

Creación de sitios de unión y separación de átomos.
Así, inmediatamente después, cada átomo de halógeno libre ocupa uno de los sitios de enlace formados en el alqueno. Como la sustancia formada tiene halógeno ligado a una estructura compuesta de carbonos e hidrógenos, es un haluro orgánico.

Ecuación que representa la formación de haluros orgánicos en halogenación
c) Hidratación
Un alqueno se mezcla con agua (H2O) en un recipiente y sometido a la acción de un catalizador (en este caso, ácido sulfúrico).
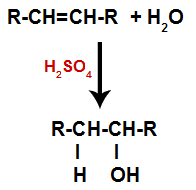
Esquema general de una reacción de hidratación en alquenos.
La presencia de ácido sulfúrico en la reacción hace que el enlace pi del alqueno y el enlace sigma entre el hidrógeno (H) y el hidroxilo (OH) del agua se rompan más rápidamente. Con eso, tenemos la creación de dos sitios de enlace en el alqueno y un hidrógeno libre y un hidroxilo en el medio de reacción.
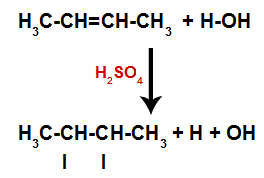
Creación de sitios de unión y separación de átomos.
Así, poco después, el hidrógeno y el hidroxilo ocupan uno de los sitios de enlace formados en el alqueno. Como la sustancia formada tiene un enlace de hidroxilo a un carbono saturado (solo hace enlaces simples), es un alcohol.
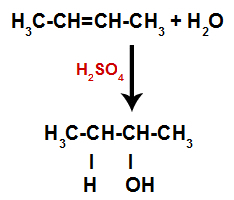
Ecuación que representa la formación de alcohol en hidratación.
d) Adición con haluros de hidrógeno
Se mezcla un alqueno con un ácido inorgánico halogenado (HF, HI, HCl, HBr) en un recipiente.

Esquema general de una reacción de haluro de ácido en alquenos
La presencia de ácido en la reacción hace que el enlace pi del alqueno se rompa más rápidamente. El enlace simple en el ácido se rompe porque estas sustancias se ionizan naturalmente. Por tanto, se crean dos sitios de unión en el alqueno y existe la presencia de un hidrógeno libre y un halógeno en el medio de reacción.
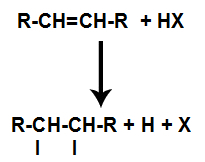
Creación de sitios de unión y separación de átomos.
Así, poco después, el hidrógeno y el halógeno ocupan uno de los sitios de enlace formados en el alqueno. Como la sustancia formada tiene halógeno unido a una estructura compuesta de carbonos e hidrógenos, es un haluro orgánico.
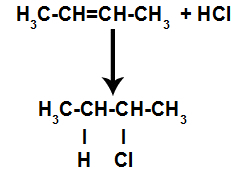
Ecuación que representa la formación de haluros orgánicos en halogenación
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm

