LA auto-oxi-reducción o reacción desproporcionada es un tipo de reacción redox en la que el mismo elemento químico se somete oxidación y reducción. Veamos dos ejemplos de este tipo de reacción y cómo equilibrarlos utilizando el método redox:
1er Ejemplo:
EN EL2- + H+ → NO3- + NO + H2O
- Calculando los números de oxidación (NOX) de todos los átomos e iones involucrados en la reacción, es posible verificar quién se oxida y quién reacciona:
+3 -2 +1 +5 -2 +2 -2 +1 -2
EN EL2- + H+ → NO3- + NO + H2O
- Tenga en cuenta que el nitrógeno fue la especie que reaccionó y se oxidó:
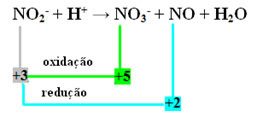
- Para equilibrar esta reacción por redox, tenemos que relacionar el NOX con los productos, no con los reactivos:
EN EL3- = ∆Nox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Invirtiendo el ∆NOX por los coeficientes, tenemos:
EN EL3- = ∆NOX = 2 → 2 será el coeficiente de NO
NO = ∆NOX = 1→ 1 será el coeficiente de NO3-
EN EL2- + H+ → 1 EN EL3- + 2 NO + H2O
- Con esto, ya sabemos que hay 3 N en el producto, por lo que el coeficiente de NO2- serán 3:
3 NO2- + H+ → 1 NO3- + 2 NO + H2O
- Para determinar los coeficientes de H+ y de H2O, recuerde que la cantidad de electrones recibidos es igual a la misma cantidad de electrones donados; por tanto, la carga de reactivo será igual a la carga de producto. De esta forma, podemos realizar el siguiente esquema:
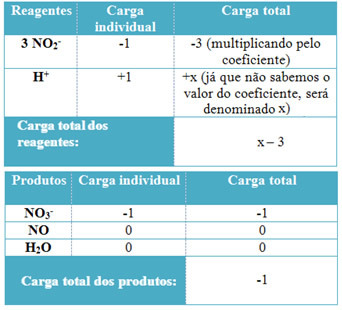
Con base en esta información, tenemos que la carga total de los reactivos es igual a x - 3 y el producto es igual a -1. Como se dijo, las cargas de los dos tienen que ser iguales. Como ya tenemos la carga total de productos, podemos realizar un cálculo sencillo para saber cuál será el valor de x:
x -3 = -1
x = -1 +3
x = 2
Por tanto, el coeficiente de H+ es 2 y, en consecuencia, el de H2El será 1:
3 NO2- + 2 H+ → 1 NO3- + 2 NO + 1 H2O
2do Ejemplo:
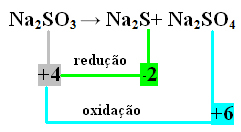
En este caso, fue el S el que sufrió reducción y oxidación al mismo tiempo. Así, como se hizo anteriormente, podemos relacionar los NOX con los productos e invertir sus valores, asignándoles los coeficientes:
A2 S = ∆Nox = 4 - (-2) = 6 → 6 será el coeficiente de Na2 SOLO4
A2 SOLO4= ∆Nox = 6 - 4 = 2 → 2 será el coeficiente de Na2 s
A2 SOLO3→ 2 A2 Y + 6 A2 SOLO4
Dado que hay 8 azufres en la segunda rama, el coeficiente de Na2 SOLO3 serán 8:
8 en2 SOLO3→ 2 en2 S + 6 adentro2 SOLO4
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm
