Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) fue un químico italiano que estableció por primera vez la idea de que un muestra de un elemento, con masa en gramos numéricamente igual a su masa atómica, siempre tiene el mismo número de átomos (NORTE).
El propio Avogadro no pudo determinar el valor de N. Sin embargo, a lo largo del siglo XX, el avance de la tecnología y el conocimiento científico hizo posible que otros científicos desarrollaran técnicas para determinarlo. Cuando finalmente se descubrió este valor, se llamó Constante de Avogadro, en honor a este científico, ya que fue él quien sentó las bases para su creación.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
En 1 mol de cualquier entidad (átomos, moléculas, electrones, fórmulas o iones) está contenido exactamente el valor de la constante de Avogadro.
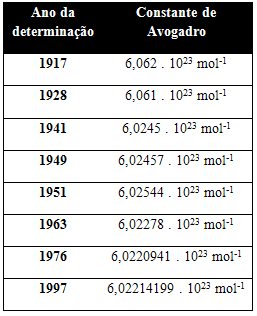
La siguiente tabla muestra algunos valores de la constante de Avogadro obtenidos a lo largo del siglo XX:
Estas son algunas de las técnicas utilizadas para intentar determinar el valor de la constante de Avogadro:
El primer científico en hacer un cálculo aproximado de la constante de Avogadro fue Johann Joseph Loschmidt. En el año 1867, se basó en la teoría cinética de los gases y determinó cuántas moléculas existían en 1 cm.3 de un gas.
Otro de estos científicos fue el francés Jean Baptiste Perrin (1870-1942) quien contó el número de partículas coloidales por unidad de volumen en una suspensión y midió sus masas. El valor que encontró estaba entre 6,5 y 7,2. 1023 entidades por mol. Este científico publicó, en 1913, el libro Les Atomes (1a ed. Paris: Alcan), y su novena edición, publicada en 1924, contenía 16 formas de obtener experimentalmente la constante de Avogadro.

Jean Baptiste Perrin (1870-1942)
Años más tarde, el científico James Dewar (1842-1923) utilizó un método desarrollado años antes por el radioquímico Bertram Boltwood (1870-1927) y el físico Ernest. Rutherford (1871-1937), que básicamente consistió en contar las partículas alfa emitidas por una fuente radiactiva y determinar el volumen de gas helio obtenido. El valor encontrado por Dewar fue 6,04. 1023 mol-1.
Allá por el siglo XX, Robert Millikan (1868-1953) llevó a cabo un experimento para determinar la carga del electrón (1.6. 10-19 C). Como ya se conocía la carga de 1 mol de electrones (96500 C), fue posible relacionar estos dos valores y encontrar el siguiente valor para la constante de Avogadro: 6.03. 1023 mol-1.
Actualmente, el valor recomendado para la constante de Avogadro es 6.02214 x 1023 mol-1 y se determina mediante difracción de rayos X, en la que se obtiene el volumen de unos pocos átomos de una red cristalina, siempre que se conozca la densidad y masa de 1 mol de átomos en la muestra.
Para fines didácticos, en la escuela secundaria, donde los cálculos no necesitan ser tan precisos como los realizados en laboratorios químicos, la constante de Avogadro se considera 6,02. 1023 mol-1.
También existen métodos más simples que pueden usarse para ayudar a los estudiantes a determinar la constante de Avogadro en la práctica. Uno de ellos es mediante electrólisis en medio acuoso.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm

