A segunda ley de la termodinámica dicta qué condiciones existen para la calor convertirse en trabajo en motores térmicos y refrigeradores. También aborda la definición de entropía como un fenómeno capaz de medir la desorganización de las partículas en los sistemas físicos.
Lea también: Calorimetría: la rama de la física que estudia el intercambio de calor.
Resumen sobre la segunda ley de la termodinámica.
La segunda ley de la termodinámica está representada por los enunciados de Clausius y Kelvin-Planck.
El enunciado de Clausius trata sobre el flujo de calor del cuerpo más caliente al cuerpo más frío.
La declaración de Kelvin-Planck aborda la incapacidad de los dispositivos térmicos para convertir todo su calor en trabajar.
La segunda ley de la termodinámica se aplica a motores térmicos y refrigeradores.
El ciclo de Carnot es el ciclo de máxima eficiencia obtenido por los motores térmicos.
El ciclo de Carnot tiene cuatro etapas, una expansión isotérmica reversible, una expansión adiabática reversible, una compresión isotérmica reversible y una compresión adiabática reversible.
El teorema de Carnot se refiere al rendimiento de maquinas de carnot.
¿Qué es la segunda ley de la termodinámica?
La segunda ley de la termodinámica es una ley que aborda las restricciones que ocurren en los procesos termodinámicos. Fue enunciada por los físicos Rudolf Clausius (1822-1888), Lord Kelvin (1824-1907) y Max Planck (1858-1947), como veremos a continuación:
El físico y matemático Rudolf Clausius afirmó que el flujo de conducción de calor se produce desde el cuerpo de mayor temperatura al cuerpo de menor temperatura. temperatura más baja, por lo tanto, no es natural que ocurra el proceso inverso, por lo tanto, es necesario realizar un trabajo sobre este sistema. Con eso, afirmó:
Es imposible llevar a cabo un proceso cuyo único efecto sea transferir calor de un cuerpo más frío a un cuerpo más caliente.|1|
El físico matemático William Thomson, conocido como Lord Kelvin, junto con las aportaciones del físico Max Planck, declaró la imposibilidad de que los dispositivos térmicos tengan una eficiencia del 100%, ya que siempre habrá pérdida de calor.
Aplicaciones de la segunda ley de la termodinámica
La segunda ley de la termodinámica se aplica a motores térmicos y refrigeradores.
Segunda ley de la termodinámica en máquinas. térmico
Hacia Máquinas térmicas son capaces de convertir el calor en trabajo. Una fuente caliente suministra calor a la máquina térmica, que lo convierte en trabajo. El resto del calor lo envía a la fuente de frío, como se muestra en la siguiente imagen:
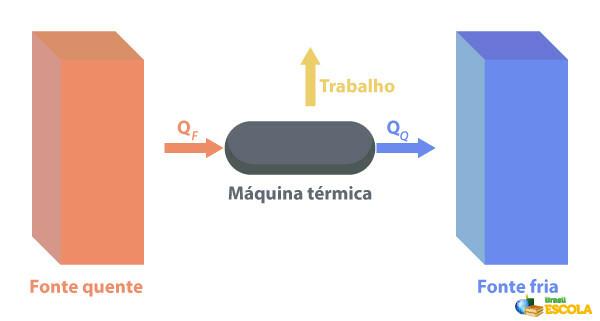
Algunos ejemplos de máquinas térmicas son: turbinas de vapor y queroseno en aviones a reacción, motores de combustión, reactores termonucleares.
Segunda ley de la termodinámica en refrigeradores
Los frigoríficos son máquinas que Funcionan de manera opuesta a los motores térmicos., donde extraen calor de una región con temperatura temperatura más baja y enviarlo a una región con una temperatura más alta. Como esto no es natural, es necesario que la máquina realice un trabajo utilizando energía eléctrica, tal como se describe en la siguiente imagen:
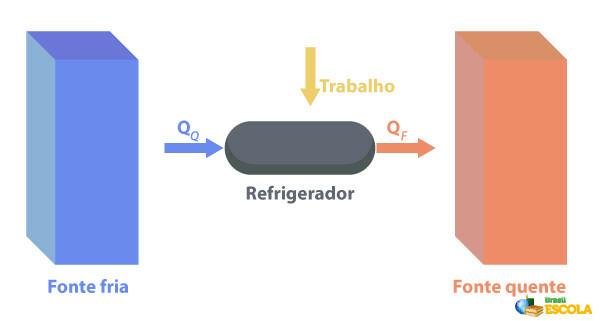
Algunos ejemplos de refrigeradores son los refrigeradores y los acondicionadores de aire.
La entropía y la segunda ley de la termodinámica
A la segunda ley de la termodinámica propone la existencia de la entropía, uno cantidad física responsable de medir el grado de desorganización de las partículas en un sistema físico o el grado de irreversibilidad de procesos termodinámicos involucrados en los motores térmicos, siendo un proceso espontáneo, inevitable, irreversible y expansivo. Con esto solo es posible observar y contener el grado de volatilidad de los procesos. A medida que aumenta la entropía, también aumenta el grado de desorden en el sistema.
A La nomenclatura de entropía es de origen griego y significa “transformación”., “cambio”, siendo así utilizado en el Físico para indicar aleatoriedad y desorden. La entropía se puede calcular usando la fórmula:
\(∆S=\frac{∆U}T\)
\(∆S\) es el cambio de entropía, medido en [J/K].
\(∆U\) es el cambio en la energía interna, medido en Joules [J].
T es la temperatura, medida en Kelvin [K].
Desde un punto de vista estadístico, la entropía se calcula mediante la fórmula:
\(S=k\cdot ln\ Ω\)
S es la entropía, medida en [J/K].
k es la constante de Boltzmann, vale \(1,4\cdot 10^{-23}\J/K\).
Ω es el número de microestados posibles para el sistema.
Lea también: Procesos de propagación del calor
Fórmulas de la segunda ley de la termodinámica.
Máquinas térmicas y frigoríficos
\(Q_Q=W+Q_F\)
\(Q_Q\) es el calor de la fuente caliente, medido en Joules [J].
W es el trabajo realizado por el motor térmico, medido en Joules [J].
\(Q_F\) es el calor de la fuente fría, medido en Joules [J].
Puede ser representado por:
\(W=Q_Q-Q_F\)
W es el trabajo realizado por el motor térmico, medido en Joules [J].
\(Q_Q\) es el calor de la fuente caliente, medido en Joules [J].
\(Q_F\) es el calor de la fuente fría, medido en Joules [J].
Refrigeradores
\(η=\frac{Q_F}{Q_Q-Q_F}\)
\(η\) es la eficiencia del refrigerador.
\(Q_F\) es el calor de la fuente fría, medido en Joules [J].
\(Q_Q\) es el calor de la fuente caliente, medido en Joules [J].
Se puede representar como:
\(η=\frac{Q_F}W\)
\(η\) es la eficiencia del refrigerador.
\(Q_F\) es el calor de la fuente fría, medido en Joules [J].
W es el trabajo realizado por el motor térmico, medido en Joules [J].
Ejemplos de aplicación de fórmulas
Ejemplo 1: Calcule el trabajo que realiza una máquina térmica durante un ciclo que recibe 500 J de calor de la fuente caliente y transfiere solo 400 J de calor a la fuente fría.
Para calcular el trabajo de una máquina térmica utilizaremos la fórmula:
\(W=Q_Q-Q_F\)
Sustituyendo los valores indicados en el extracto:
\(W=500-400\)
\(W=100\J\)
El trabajo de la máquina térmica fue de 100 julios.
Ejemplo 2: ¿Cuál es la eficiencia de un refrigerador que recibe 150 J de calor de la fuente caliente y transfiere 50 J de calor a la fuente fría?
Para calcular la eficiencia de un frigorífico, utilizaremos la fórmula:
\(η=\frac{Q_F}{Q_Q-Q_F}\)
Sustituyendo los valores dados en el enunciado, obtenemos:
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
Multiplicando el rendimiento por 100%:
\(η=0.5\cdot100%\)
\(η=50\%\)
El refrigerador tiene una eficiencia del 50%.
Ciclo de Carnot
El ciclo de Carnot fue desarrollado por el científico Sadi Carnot (1796-1832), con el objetivo de identificar la máxima eficiencia que puede alcanzar un motor térmico que opera entre una fuente caliente y una fuente fría.
Con base en sus estudios, Carnot identificó que, para obtener la máxima eficiencia de una máquina térmica, es necesario para que su proceso sea reversible, por lo que desarrolló el ciclo de máximo rendimiento llamado ciclo de Carnot y el La máquina térmica que trabaja a través de él se llama máquina térmica de Carnot.. Dado que el ciclo de Carnot es reversible, se puede invertir, que es como se desarrollaron los refrigeradores.
El ciclo de Carnot, independientemente de la sustancia utilizada, se compone de cuatro procesos descritos en la gráfica de presión por volumen (p×V), como podemos ver en la siguiente imagen:
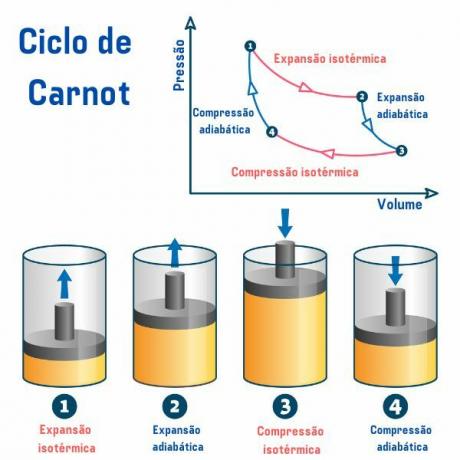
1er proceso, del punto 1 → 2: existe una expansión isotérmica reversible (proceso en el que la temperatura permanece constante), en la que el gas (o sistema) realiza trabajo y adquiere una cantidad de calor de la fuente caliente.
2do proceso, del punto 2 → 3: hay una expansión adiabática (proceso en el que hay intercambio de calor con el medio exterior) reversible, en el que no hay intercambio de calor calor con fuentes térmicas, pero el gas sí trabaja y se produce una disminución de su energía interna, provocando una disminución de la temperatura.
3er proceso, del punto 3 → 4: se produce una compresión isotérmica reversible, en la que el gas recibe trabajo y cede una cantidad de calor a la fuente fría.
4to proceso, desde el punto 4 → 1: se produce una compresión adibática reversible, en la que no se produce intercambio de calor con las fuentes térmicas y el gas se calentarse hasta alcanzar la temperatura de la fuente caliente, y así ponerse en contacto con ella, finalizando el ciclo.
leyes de la termodinámica
Las leyes de la termodinámica son cuatro leyes que gobiernan todo el estudio de termodinámica, estudia las relaciones entre el volumen, la temperatura y la presión y otras cantidades físicas, como el calor y la energía.
Ley cero de la termodinámica: es la ley de balance térmico, estudia el intercambio de calor entre cuerpos que tienen diferentes temperaturas.
primera ley de la termodinámica: es la ley de conservación de la energía en los sistemas termodinámicos, estudia la transformación del calor en trabajo y/o energía interna.
Segunda ley de la termodinámica: es la ley que se ocupa de los motores térmicos, los refrigeradores y la entropía.
Tercera ley de la termodinámica: es la ley de cero absoluto, estudia los efectos de esta temperatura.
Lee también: Rendimiento de los motores térmicos
Ejercicios resueltos sobre la segunda ley de la termodinámica
Pregunta 1 Determine la temperatura de la fuente caliente de una máquina de Carnot, sabiendo que la temperatura de la fuente fría es de 450 K y su eficiencia es del 80%.
a) 2250K
segundo) 450K
do) 1500K
re) 900K
e) 3640K
Resolución:
alternativa a Calcularemos la temperatura de la fuente caliente en base a la fórmula de eficiencia de un motor de Carnot:
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\K\)
Pregunta 2 (Cefet-PR) El 2º principio de la termodinámica puede enunciarse así: “Es imposible construir una máquina energía térmica que opera en ciclos, cuyo único efecto es quitar calor de una fuente y convertirlo integralmente en trabajar". Por extensión, este principio nos lleva a concluir que:
a) Siempre es posible construir máquinas térmicas cuya eficiencia sea del 100%.
b) cualquier máquina térmica necesita solo una fuente de calor.
c) el calor y el trabajo no son cantidades homogéneas.
d) cualquier motor térmico extrae calor de una fuente caliente y rechaza parte de ese calor a una fuente fría.
e) sólo con una fuente fría, mantenida siempre a 0 °C, sería posible que una cierta máquina térmica convirtiera el calor por completo en trabajo.
Resolución:
alternativa d Este principio nos informa que es imposible quitar todo el calor de la fuente caliente y transferirlo a la fuente fría.
Nota
|1| Curso de física básica: Fluidos, Oscilaciones y Ondas, Calor (vol. 2).
Por Pamella Raphaella Melo
Profesor de física
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/fisica/segunda-lei-da-termodinamica.htm

