Tú gases ellos son fluidos que, a diferencia de los líquidos, ocupan todo el espacio disponible del contenedor donde se encuentran confinados. Las moléculas que componen los gases son libres de moverse e interactuar entre sí y con las paredes del recipiente.
O gas perfecto o ideal es un gas idealizado, tiene características particulares y cumple con las ley general de los gases y el Ecuación de Clapeyron.
Características de los gases perfectos
No hay interacción gravitacional entre moléculas;
A colisiones entre las moléculas están perfectamente elástico, es decir, hay una conservación total de la energía cinética;
Las moléculas exhiben un movimiento desordenado y velocidades que dependen directamente del valor de temperatura del gas;
El volumen adecuado de cada molécula es completamente insignificante en comparación con el volumen total del gas.
Variables de estado
Presión, temperatura y el volumen son los cantidades físicas escalares que caracterizan a un gas. Estas cantidades se denominan variables de estado y mantienen relaciones de proporcionalidad.
LA Ley de Boyledetermina que la relación entre la presión y el volumen de un gas es inversamente proporcional. Cuanto mayor es la presión sobre las moléculas, menos espacio ocupan.
LA Ley de Gay-Lussacdetermina que la relación entre el volumen y la temperatura de un gas es directamente proporcional. Cuanto mayor sea la temperatura de un gas, mayor será la agitación de las moléculas, que tenderán a separarse, aumentando el espacio que ocupan.
Ley de Charles determina que la relación entre la presión y la temperatura de un gas es directamente proporcional. Cuanto mayor es la temperatura de un gas, mayor es la agitación molecular. Así, aumenta la incidencia de colisiones entre las moléculas y las paredes del recipiente, aumentando la presión del gas.
LA ecuación de clapeyron sintetiza las tres leyes presentadas anteriormente y determina una sola relación entre las variables de estado.
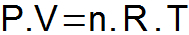
P = presión de gas (atm o N / m2);
V = volumen de gas (L om3);
n = número de lunares;
R = constante universal de gas (0.082 atm.l / mol. K o 8,31 J / mol. K);
T = temperatura del gas (K).
Gas ideal en la naturaleza
La naturaleza no produce gases que tengan las características de un gas perfecto. El gas ideal es un modelo teórico y útil para comprender el comportamiento de los gases ante cambios en sus características.
Por Joab Silas
Licenciada en Física
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm

