El equilibrio dinámico o equilibrio químico de una reacción ocurre cuando las reacciones directa e inversa ocurren simultáneamente. Estos llamados sistemas reversibles están representados por flechas en ambas direcciones:  o
o  . Un ejemplo de una reacción reversible se cita en la imagen de arriba, entre el gas de yodo y el gas de hidrógeno.
. Un ejemplo de una reacción reversible se cita en la imagen de arriba, entre el gas de yodo y el gas de hidrógeno.
Al comienzo de la reacción, la cantidad de reactivos es máxima y la de productos es cero. Sin embargo, los reactivos reaccionan entre sí, disminuyendo su concentración y aumentando la de los productos formados. La velocidad de desarrollo de la reacción directa también está disminuyendo.
A medida que aumenta la concentración de los productos, comienza la reacción inversa y los reactivos se forman de nuevo; también aumenta la velocidad de desarrollo de la reacción inversa.
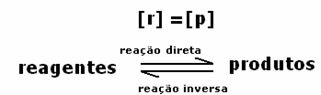
Al alcanzar el equilibrio químico, a temperatura constante, las tasas de desarrollo de las reacciones directa e inversa son iguales.
Todasdirecto = Todo inverso
Las tasas son las mismas, pero las concentraciones no. Es poco probable que las concentraciones de reactivos y productos sean las mismas. Solo en casos raros ocurre esto. En la mayoría de los casos, la concentración de reactivos será mayor que la de los productos o viceversa.
Por lo tanto, tenemos tres formas posibles de representar gráficamente las tasas de desarrollo de reacciones directas e inversas, relacionando las concentraciones de reactivos y productos sobre el hora. Veamos cada caso:
1er caso: Iguales concentraciones:
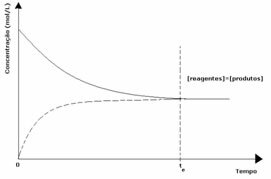
Como se ve en el gráfico, en el momento ty las reacciones directa e inversa son las mismas, en cuyo caso las concentraciones de reactivos y productos son las mismas. Por lo tanto, el equilibrio no se desplaza hacia ningún lado, la intensidad de ambas reacciones es la misma, como se expresa a continuación:
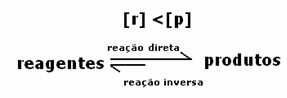
2do caso: Concentración de reactivos mayor que concentración de productos:
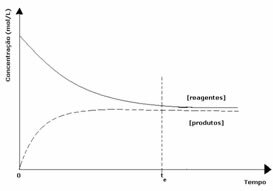
En este caso, se observa que al alcanzar el equilibrio, la concentración de reactivos es mayor que la de los productos. Así, se concluye que si hay más reactivo, la reacción inversa se está produciendo con mayor intensidad. La reacción se desplaza hacia la izquierda:
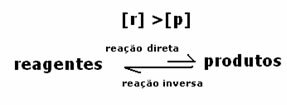
3er caso: Concentración de productos superior a la de reactivos:
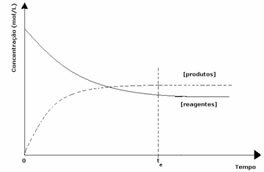
Dado que en el equilibrio la concentración de productos es mayor, esto significa que la reacción es desplazado a la derecha, porque la reacción directa (con formación de productos) ocurre con mayor intensidad.
Lo que indicará si la reacción tiende a la derecha oa la izquierda será la constante de equilibrio K, que solo depende de la temperatura.
Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm