Como se explica en el texto Reacciones de adición, estas reacciones orgánicas generalmente ocurren con compuestos que tienen insaturación (dobles enlaces o triples), en el que se rompe el enlace pi, lo que permite la entrada de átomos o grupos de átomos en la cadena. carbónico.
Sin embargo, este tipo de reacción también ocurre en el caso de cicloalcanos (hidrocarburos de cadena cerrada con solo enlaces saturados (simples) entre carbonos) que tienen tres o cuatro átomos de carbono. Tenga en cuenta un ejemplo a continuación, que es la bromación (reacción de halogenación) del ciclopropano:
CH2
/ \ + br2 → br ─ CH2 ─ CH2 ─ CH2 ─ br
H2C CH2
Asimismo, también existe la reacción de adición denominada hidrohalogenación o la adición de haluro, como se muestra a continuación:
CH2
/ \ + HBr → H ─ CH2 ─ CH2 ─ CH2 ─ br
H2C CH2
Tenga en cuenta que, en ambos casos, la molécula se rompió y se produjeron compuestos de cadena abierta.
Pero esto no sucede tan fácilmente en cicloalcanos con cinco o más átomos de carbono.
Por otro lado, es más probable que estos compuestos funcionen reacciones de sustitución, en el que el enlace no se rompe, sino que uno o más átomos de hidrógeno unidos al carbono son reemplazados por átomos de otros elementos.El ciclopentano todavía puede llevar a cabo reacciones de adición, pero solo a temperaturas más altas (alrededor de 300 ° C). En el caso del ciclohexano, esto es muy difícil. Lo que realmente hace son reacciones de reemplazo, como la siguiente cloración:
CH2 CH2
/ \ / \
H2C CH2 H2C CH ─ Cl
│ │ + Cl2→ │ │ + HCl
H2C CH2 H2C CH2
\ / \ /
CH2 CH2
Los anillos con cinco o más átomos de carbono no reaccionan con ácidos hidrohálicos, como HBr, además de reacciones.
Pero, ¿por qué ocurre esto? ¿Por qué los cicloalcanos de tres o cuatro carbonos llevan a cabo reacciones de adición y los cicloalcanos con más átomos de carbono tienden a no hacerlo?
Bueno, eso se debe a que el ciclopropano y el ciclobutano son más inestables, por lo que es más fácil romper sus enlaces.
Johann Friedrich Adolf von Bayer (1835-1917)
Para explicar esto, el químico alemán Johann Friedrich Adolf von Bayer (1835-1917) desarrolló, en 1885, el llamado Teoría de la tensión del anillo, que demostró que los cuatro enlaces formados por los átomos de carbono serían más estables cuando tuvieran un ángulo igual a 109º 28 ', como es el caso del siguiente metano:

Los cuatro enlaces simples de metano tienen un ángulo de 109º 28 '
Este es el ángulo más estable porque corresponde a la mayor distancia posible entre átomos en una geometría tetraédrica. Con esto, la repulsión electrónica (repulsión entre los electrones en las capas de valencia de los átomos) se vuelve más pequeña.
Los cicloalcanos con tres, cuatro y cinco carbonos tienen ángulos de enlace entre carbonos menores de 109º 28 '. Vea:
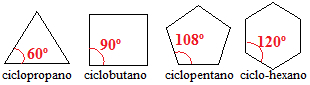
Ángulos de enlaces cicloalcanos
Con base en estos ángulos reales, que genéricamente podemos llamar α, el cálculo de la tensión de enlace se puede realizar utilizando la siguiente fórmula:
tensión = 109º 28' - α
2
Sabemos que el ciclopropano es el cicloalcano más inestable y también el más reactivo, y esto se confirma calculando el voltaje de su anillo en comparación con los demás:
voltaje de ciclopropano = 109º 28' – 60º = 109º – 60º + 28' = 49º + 28' = 24,5º + 14
2 2 2
Como 0.5º = 30, entonces tenemos:
voltaje de ciclopropano = 24º + 30 '+ 14' = 24º 44'
voltaje de ciclobutano = 109º 28' – 90º = 9º 44'2
voltaje ciclopentano = 109º 28' – 108º = 0º 44'2
Según la teoría de las tensiones de Bayer, cuanto mayor sea esta tensión, más inestable será el ciclan, es decir, mayor será la diferencia entre el ángulo real (α) y el ángulo teórico (109º 28 '), más inestable y, en consecuencia, más reactivo será el sustancia.
Es por eso que el ciclopropano es el menos estable de los cicloalcanos.
Sin embargo, hubo un error en la teoría de Bayer, porque si seguimos haciendo este cálculo de estrés para el ciclohexano, donde el ángulo de conexión es de 120 °, veremos que el valor será incluso menor que el del ciclopropano, dando igual a -5 ° 16 '. Esto indicaría que el ciclohexano debería ser aún más inestable y llevar a cabo reacciones de adición, lo que no es el caso en la práctica.
La explicación de este hecho fue encontrada, en 1890, por el químico alemán Hermann Sachse y probada, en 1918, por el también químico alemán Ernst Mohr. Según estos científicos, el error en la teoría de la tensión del anillo de Bayer radicaría en el hecho de que consideraba que todos los cicloalcanos son coplanares, es decir, todos sus átomos de carbono están en un solo plano, coutilice los dibujos de sus estructuras que se muestran arriba.
Sin embargo, en realidad, los anillos de cicloalcanos con más de cinco átomos de carbono no son planos, sino sus átomos. adquieren conformaciones espaciales que anulan las tensiones entre las uniones, estableciendo un ángulo de 109º 28 'entre los Conexiones.
Por ejemplo, observe el caso del ciclohexano. No es, de hecho, plano con un ángulo de 120 ° entre sus enlaces, sino que, de hecho, sus átomos "giran", formando dos conformaciones posibles, la conformación de "silla" y la de "bote":
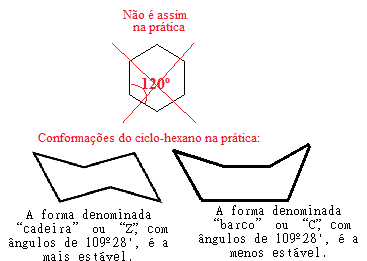
Posibles conformaciones del ciclohexano en la práctica.
Nótese que, debido a que el ángulo real del ciclohexano es de 109º 28 ', es un compuesto muy estable, por lo que su molécula no se rompe, por lo que no participa en las reacciones de adición. También tenga en cuenta que la forma de "silla" es la más estable, siendo la que siempre predomina en las mezclas, esta porque, en esta conformación, los átomos de hidrógeno unidos al carbono están más separados entre sí. otros.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/teoria-das-tensoes-dos-aneis-bayer.htm
