Reacciones de oxidación-reducción que ocurren en presencia de peróxido de hidrógeno (solución acuosa de peróxido de hidrógeno - H2O2 (aq)) constituyen un caso especial que debe analizarse por separado, principalmente en lo que respecta a su equilibrio. Esto se debe a que los oxígenos en el peróxido de hidrógeno, que tienen Nox igual a -1, pueden oxidarse o reducirse.
Por ejemplo, veamos dos casos en los que se comporta primero como agente oxidante (reductor) y luego como agente reductor (oxidante):
- agente oxidante: siempre que se reduce el peróxido de hidrógeno, actuando como agente oxidante, genera agua como producto.
Si agregamos una solución de peróxido de hidrógeno a una solución que contiene iones de yoduro (I-) en medio ácido tendremos:
H2O2 (aq) + Yo-(aquí) + H+(aquí) → H2O(1) + Yo2 (s)
Vea que se formen agua y yodo. Pero para comprobar si el peróxido de hidrógeno actuó realmente como un agente oxidante y se redujo, observe la determinación de los números de oxidación (NOx): *

El oxígeno Nox del peróxido de hidrógeno disminuyó de -1 a -2, dado que recibió 1 electrón. Sin embargo, como tenemos dos oxígenos en cada molécula de peróxido de hidrógeno (H
2O2), la variación de Nox será igual a 2.Entonces, como se muestra en el texto "Equilibrio redox”, Un paso necesario para equilibrar las reacciones por el método de oxidación-reducción es invertir los valores de las variaciones del Nox por los coeficientes, siendo, en este caso, el siguiente:
* H2O2 = 2 (∆Nox) = 2 → 2 será el coeficiente de la I-;
* I-= ∆Nox = 1 → 1 será el coeficiente de H2O2.
Así tenemos:
1 hora2O2 (aq) + 2 yo-(aquí) + H+(aquí) → H2O(1) + Yo2 (s)
Alcanzar los otros coeficientes equilibrando por ensayos:
- Dado que hay dos átomos de oxígeno en el primer miembro, el coeficiente de agua en el segundo miembro debe ser igual a 2. Y dado que también hay dos iones de yoduro en el primer miembro, el coeficiente de yodo en el segundo miembro será 1. No olvide que tenemos que multiplicar el índice por el coeficiente para encontrar la cantidad correcta de átomos e iones en cada miembro:
1 hora2O2 (aq) + 2 yo-(aquí) + H+(aquí) → 2 H2O(1) + 1 yo2 (s)
- Ahora solo queda equilibrar el catión de hidrógeno del 1er miembro, y su coeficiente tendrá que ser igual a 2, porque en el 2do miembro tiene 4 hidrógenos y en el 1er miembro ya tiene dos:
1 hora2O2 (aq) + 2 yo-(aquí) +2 H+(aquí) → 2 H2O(1) + 1 yo2 (s)
- agente reductor: siempre que el peróxido de hidrógeno se oxida, actuando como agente reductor, genera oxígeno (O2) como producto.
Un ejemplo de reducción del peróxido de hidrógeno es cuando entra en contacto con el permanganato de potasio (KMnO4). Esta sustancia tiene un color violeta muy característico, pero cuando entra en contacto con el peróxido de hidrógeno se vuelve incolora. Esto se debe a que todo el manganeso presente en el ion MnO4- de la solución de permanganato se reduce, dando lugar al ion Mn2+, Como se muestra abajo:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2O2 + MnO4-+ H+ → El2 + Mn2++ H2O
Calculando el Nox, vemos que el oxígeno en el peróxido de hidrógeno en realidad se oxida y provoca la reducción del manganeso:
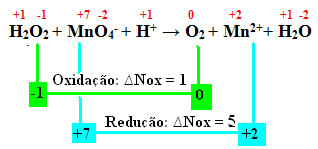
Como en el ejemplo anterior, el ∆Nox del peróxido de hidrógeno será igual a 2, ya que hay dos oxígenos y cada uno pierde un electrón. Por tanto, tenemos:
* O2 = 2 (∆Nox) = 2 → 2 será el coeficiente de MnO4-;
* MnO4- = ∆Nox = 5 → 5 será el coeficiente de la O2.
Y como todo O2 proviene del peróxido de hidrógeno, las dos sustancias tienen el mismo coeficiente:
5 H2O2 + 2MnO4-+ H+ → 5 O2 + Mn2++ H2O
Equilibrando por el método de prueba, tenemos:
5 horas2O2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 Mn2++ 8 H2O
* Para cualquier pregunta sobre cómo calcular el número de oxidación (Nox) de átomos e iones en una reacción, lea el texto “Determinación del número de oxidación (NOx)”.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm

