el elemento químico fósforo (P) pertenece al tercer período de la tabla periódica y a la familia del nitrógeno (VA). Por esta razón, sus átomos normalmente forman tres enlaces químicos para llegar a la teoría del octeto (estabilidad). Sin embargo, hay algunas situaciones en las que un átomo de fósforo forma más de tres enlaces, hecho que solo es posible a través de la fenómeno de hibridación.
Para entender el hibridación de fósforo, primero debemos entender por qué el átomo de este elemento forma tres enlaces. Para hacer esto, solo necesitamos monitorear su distribución electrónica:

Distribución electrónica de fósforo
Podemos observar que, en la capa de valencia, el átomo de fósforo tiene el subnivel de 3s completo (con dos electrones) y el subnivel 3p incompleto (cada uno de los tres orbitales del subnivel p tiene un electrón). A continuación tenemos la distribución de los electrones en los orbitales de los subniveles del Capa de valencia de fósforo:
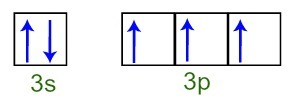
Representación de los electrones de la capa de valencia del átomo de fósforo
Como cada uno de los orbitales de subnivel 3p está incompleto, el átomo de fósforo puede formar tres enlaces químicos, logrando así la estabilidad.
Ahora, cuando miramos la sustancia PCl5Por ejemplo, tenemos la certeza de que, en esta molécula, el fósforo sufrió una hibridación, ya que realizó cinco conexiones. Como el cloro, que pertenece a la familia VIIA, necesita un enlace para ser estable y la molécula tiene cinco átomos de este elemento, cada uno de ellos debe formar un enlace, lo que hace que el átomo de fósforo, a su vez, también tenga que formar cinco Conexiones. Esta ocurrencia solo es posible a través del hibridación (unión de orbitales atómicos incompletos) de fósforo.
Al recibir energía del entorno externo, los electrones del átomo de fósforo se excitan. Poco después, uno de los dos electrones pertenecientes al subnivel 3s se mueve a un orbital vacío presente en el subnivel d, que hasta entonces no tiene electrones. Vea el diagrama a continuación:
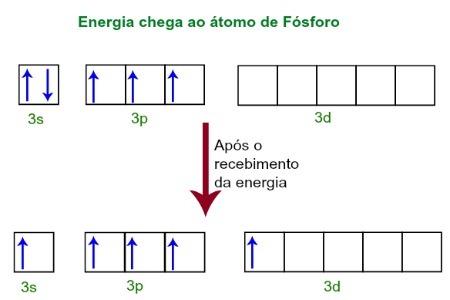
Al recibir energía, los electrones del fósforo se excitan y uno ocupa un orbital del subnivel d.
En este momento, tenemos en la capa de valencia del fósforo un orbital s, tres orbitales p y un orbital d incompleto.En última instancia, estos cinco orbitales se hibridan, es decir, se fusionan, dando como resultado cinco orbitales atómicos incompletos, que ahora son capaces de formar cinco enlaces químicos.

Hibridación de orbitales atómicos incompletos de fósforo
Como un orbital s, tres orbitales p y un orbital d se unieron, la hibridación de fósforo es del tipo sp3D.
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm

