A baterías ordinarias son llamados Baterías Leclanché el nombre de su inventor, el químico francés George Leclanché (1839-1882).

George Leclanché (1839-1882)
Leclanché creó este tipo de batería en el año 1866. Ella también se llama pila seca porque hasta entonces solo había baterías que usaban soluciones acuosas, como Pila de Daniell.
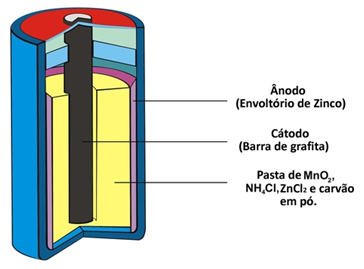
Otros dos nombres que recibe este tipo de pilotes por su constitución son pila de ácido o batería de zinc-carbono. Básicamente está formado por una envoltura de zinc separada del resto de especies químicas que componen la pila mediante un papel poroso.
Este zinc corresponde al polo negativo de la celda o ánodo, a medida que se oxida, perdiendo dos electrones, según la siguiente semirreacción:
Polo negativo - Ánodo: Zn (s) → Zn2+(aquí) + 2 y-
Esta pila también tiene un polo positivo, el cátodo, que es una barra de grafito instalada en el medio de la pila rodeada de dióxido de manganeso (MnO2), carbón vegetal en polvo (C) y una pasta húmeda que contiene cloruro de amonio (NH4Cl), cloruro de zinc (ZnCl2) y agua (H2O).
El cloruro de amonio y el cloruro de zinc son sales de carácter ácido, de ahí el nombre de "célula ácida".
La barra de grafito conduce los electrones perdidos por el zinc al manganeso, reduciendo el dióxido de manganeso (MnO).2) al trióxido de manganeso (Mn2O3), según la siguiente semirreacción:
Polo positivo - Cátodo: 2 MnO2 (aq) + 2 NH41+(aquí) + 2e- → 1 Mn2O3(s) + 2NH3 (g) + 1 hora2O(1)
La pasta húmeda actúa como un punto de sal, permitiendo la migración de aniones hidroxilo (OH-) del grafito al zinc.
La reacción general viene dada por:
Zn (s) + 2 MnO2 (aq) + 2 NH41+(aquí) → Zn2+(aquí) + 1 Mn2O3(s) + 2NH3 (g)
Como tal, estas baterías no son recargables ya que todo el dióxido de manganeso se convierte en trióxido de manganeso. Cuando la batería deja de funcionar, debe desecharse.
El ddp de estas baterías es de 1,5 V. Sin embargo, el amoníaco (NH3 (g)) formado en el cátodo puede depositarse sobre la barra de grafito, dificultando el paso de electrones y reduciendo el voltaje de la batería. Para volver al funcionamiento normal, simplemente deje la batería fuera del dispositivo, ya que el catión zinc (Zn2+(aquí)) formado en el ánodo reacciona con el amoniaco, dejando libre la barra de grafito.
Además, colocar la pila en el frigorífico también puede ayudar, ya que bajar la temperatura favorece la solubilidad del amoniaco en la pasta húmeda de la pila.
Otro factor importante sobre las celdas secas de Leclanché que debemos tener en cuenta es que la carcasa de zinc puede corroerse y, por lo tanto, filtrar el material corrosivo y dañar el dispositivo.. Por tanto, lo mejor que puedes hacer es no dejar las baterías dentro de dispositivos que no se utilicen de forma continuada.
Las baterías secas están indicadas para equipos que requieren una descarga ligera y continua, como control remoto, reloj de pared, radio portátil y juguetes.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm
