El hielo seco se llama así porque a pesar de tener la apariencia de hielo (agua en estado sólido), en realidad es dióxido de carbono sólido (dióxido de carbono - CO2). Y, a diferencia del hielo ordinario que se derrite, pasa directamente a un estado gaseoso, es decir, se sublima.
Esta es la propiedad más importante del hielo seco, porque cuando cambia a un estado gaseoso, arrastra moléculas de agua con él, creando una niebla más densa que el aire. gracias a ello "Humo blanco" formado, el hielo seco se utiliza ampliamente como recurso escénico en películas, conciertos, teatros, programas de televisión y fiestas.
Pero surge la pregunta: ¿en qué se diferencia el hielo seco de otras sustancias involucradas en su sublimación? ¿Qué pasa entre tus moléculas?
El dióxido de carbono no es polar, por lo que cuando está en estado sólido, como el hielo seco, su las moléculas permanecen en cristales moleculares gracias a una fuerza de atracción intermolecular entre ellas, Cuál es el dipolo inducido. Esta fuerza surge cuando sus moléculas se acercan y hay una repulsión entre sus electrones, lo que lleva a deformaciones momentáneas en sus nubes electrónicas. Esto significa que aparecen dipolos momentáneos en las moléculas, que inducen moléculas adyacentes, lo que resulta en fuerzas de atracción.
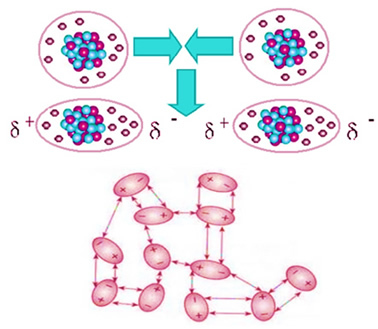
Esta es la única fuerza intermolecular presente en las moléculas apolares de hielo seco y su intensidad es muy pequeña. La fuerza dipolar inducida es la más débil de todas.. Así, se necesita poca energía para romper estas fuerzas de atracción y hacen que el compuesto cambie su estado físico. Es por eso que el hielo seco se sublima a -78,6 ° C, bajo una presión de 1 atm.
Otros ejemplos de sustancias que también tienen este tipo de interacción intermolecular y que también subliman son bolas de naftalina es el yodo sólido.

Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/por-que-gelo-seco-sublima.htm

