osmoscopia es una Co-propiedad (los otros son tonoscopia, ebulloscopia y crioscopia) que estudia la aparición de ósmosis entre dos soluciones de diferentes concentraciones, una de las cuales está más concentrada que la otra.
Nota: Las propiedades coligativas ocurren cuando se agrega un soluto no volátil a un solvente.
Como a osmoscopia estudiar ósmosis, es fundamental saber Qué es este fenómeno. Para ello, utilizaremos las soluciones a continuación, que están separadas por una membrana semipermeable:
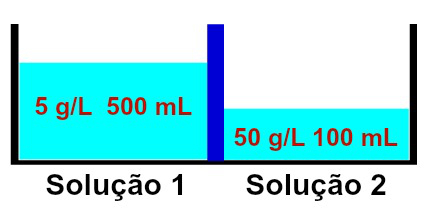
Representación de soluciones que tienen diferentes concentraciones.
Se observa que la solución 1 contiene una concentración de 5 g / L y un volumen de 500 mL, mientras que la La solución 2 tiene una concentración de 50 g / L y un volumen de 100 mL, separados por una membrana semipermeable. La solución 2 está más concentrada que la solución 1 y, por lo tanto, la ósmosis debe ocurrir entre ellas.
La ósmosis debe ocurrir necesariamente de la solución 1 a la solución 2, ya que la solución 1 está menos concentrada. Durante esta ocurrencia, parte del solvente atraviesa la membrana semipermeable, haciendo que el volumen de la solución 2 aumentar y disminuir el volumen de la solución 1, hasta que ambas soluciones comiencen a tener la misma concentración, es decir, isotonía.

Modificación en altura de las soluciones 1 y 2 debido a la ocurrencia de ósmosis
Nota: Los medios isotónicos son aquellos cuya concentración es igual.
De acuerdo con osmoscopia, la ósmosis tiene lugar porque la presión de vapor máxima del solvente en la solución menos concentrada es mayor que la del solvente en la solución más concentrada. Ahora, si queremos prevenir la ocurrencia de ósmosis, simplemente ejerzamos presión sobre la solución más concentrada:
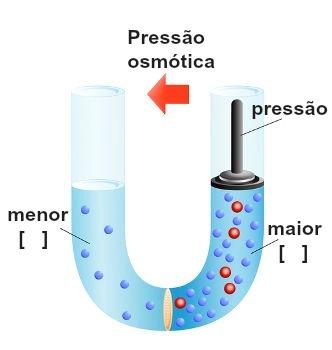
Representación de la ejecución de presión sobre la solución más concentrada
Esta presión, que se ejerce sobre la solución más concentrada para bloquear o incluso la ósmosis inversa, se denomina presión osmótica y está representado por el símbolo π. Debe ser directamente proporcional a la concentración de la solución.
Posibles interpretaciones de la presión osmótica
Según las conclusiones del osmoscopia, cada solución tiene una presión osmótica, ya que esta está relacionada con la concentración, característica presente en toda solución.
Al comparar un medio o una solución con otro, podemos utilizar los siguientes términos:
Hipertónico: cuando un medio presenta una presión osmótica mayor que el otro;
hipotónico: cuando un medio tiene una presión osmótica más baja que el otro;
Isotónico: cuando los dos medios o soluciones tienen la misma presión osmótica.
Así, al comparar las presiones osmóticas de dos soluciones A y B, representadas por πLA y πB, podemos decir eso :
Si la presión osmótica de A y B son iguales, las medias o soluciones serán isotónicas:
πLA = πB
Si la presión osmótica de A es mayor que la presión osmótica de B, el medio A será hipertónico en relación con B:
πLA> πB
Si la presión osmótica de B es menor que la presión osmótica de A, el medio B será hipotónico en relación con B:
πB< πLA
Fórmula para calcular la presión osmótica
π = M.R.T
En esta fórmula:
π = es la presión osmótica
M = es el concentración en mol / L
R = es la constante general del gas (0.082 para presión en atm; 62,3 para presión en mmHg)
T = temperatura en Kelvin
Como la concentración en mol / L tiene una fórmula particular, como se muestra a continuación:
M = metro1
METRO1.V
Podemos reemplazarlo en la fórmula de presión osmótica:
π = metro1.R.T
METRO1.V
Nota: Si el soluto presente en la solución es iónico, debemos usar el Factor de corrección de Van't Hoff (i) en la expresión del cálculo de la presión osmótica:
π = M.R.T.i
Ejemplo de cálculo de presión osmótica
Ejemplo: (UF-PA) Una solución que contiene 2 mg de un nuevo antibiótico, en 10 mL de agua, a 25 ºC, produce una presión osmótica de 0.298 mmHg. Entonces, la masa molecular de este antibiótico es, aproximadamente:
a) 3000
b) 5200
c) 7500
d) 12500
e) 15300
Los datos proporcionados por el ejercicio fueron:
π = 0,298 mmHg
T = 25 OC o 298 K (después de sumar con 273)
metro1 = 2 mg o 0,002 g (después de dividir por 1000)
V = 10 mL o 0.01 L (después de dividir por 1000)
R = 62,3 mmHg
Para resolver este ejercicio, basta con aplicar los datos disponibles en la expresión para calcular la presión osmótica, de la siguiente manera:
π = metro1.R.T
METRO1.V
0,298 = 0,002.62,3.298
METRO1.0,01
0.298.M1.0,01 = 37,1308
0.00298.M1 = 37,1308
METRO1 = 37,1308
0,00298
METRO1 = 12460 u
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-osmoscopia.htm


