A sublimación Es un cambio en el estado físico de la materia caracterizado por el paso directo de la fase sólida a la fase gaseosa, sin pasar por la fase líquida. Estrictamente hablando, cualquier sustancia puede sufrir sublimación, pero bajo condiciones específicas de presión y temperatura. La sublimación está correlacionada con la presión de vapor en la fase sólida, así como con las interacciones intermoleculares ejercidas por los sólidos.
Este proceso se puede observar fácilmente en un trozo de hielo seco, que consiste en dióxido de carbono sólido. El dióxido de carbono se sublima bajo presión ya temperatura ambiente. El proceso opuesto a la sublimación puede llamarse resublimación o deposición. Para que se produzca la sublimación, la materia debe absorber energía, por lo que se considera un proceso endotérmico.
Lea también: ¿Cuáles son los estados físicos de la materia?
Temas de este artículo
- 1 - Resumen sobre la sublimación
- 2 - ¿Qué es la sublimación?
-
3 - Operación de sublimación
- ¿Qué es la presión de vapor?
- Presión de vapor y sublimación
- Diagrama de fases
- 4 - Ejemplos de sublimación
- 5 - Ejercicios resueltos de sublimación
Resumen sobre la sublimación
La sublimación es el paso directo de la fase sólida a la fase gaseosa, sin pasar por la fase líquida.
Son necesarias condiciones específicas de presión y temperatura para observar la sublimación de una sustancia.
La sublimación está influenciada por aspectos termodinámicos, como la presión de vapor en la fase sólida y las interacciones intermoleculares.
La sublimación es un proceso endotérmico.
Un ejemplo de sublimación es lo que ocurre en el hielo seco, que consiste en dióxido de carbono sólido.
¿Qué es la sublimación?
la sublimación es la transición directa de la fase sólida a la fase gaseosa, sin pasar por la fase líquida. Ocurre bajo condiciones específicas de temperatura y presión para algunos sólidos. Esta transición es un proceso físico de cambio de estado, que no involucra reacciones químicas.
El proceso inverso, es decir, el paso directo de la fase gaseosa a la fase sólida, se denomina de diversas formas. Algunos autores mantienen la palabra sublimación para este cambio de fase, mientras que otros utilizan “resublimación” e incluso “deposición”.
No pares ahora... Hay más después de la publicidad ;)
Cómo funciona la sublimación
Se puede trazar un paralelo entre la sublimación y la evaporación. En ambos casos, el punto final es fase gaseosa. La diferencia, obviamente, está en la fase inicial: sólido para la sublimación y líquido para la evaporación.
En ambos casos, hay influencia de la presión vapor y también aspectos termodinámicos, que involucran calor e interacciones intermoleculares.
¿Qué es la presión de vapor?
En un recipiente cerrado que contiene un líquido, es posible percibir que existe un equilibrio entre la fase líquida y la fase vapor. Esto ocurre porque, incluso por debajo de la temperatura de ebullición, la energía presente es suficiente para que algunas moléculas del líquido se desprendan y pasen al vapor. Sin embargo, algunas moléculas de vapor también pueden condensarse nuevamente y volver a la fase líquida, lo que demuestra la reversibilidad del proceso.
Este vapor, al estar hecho de materia (tiene masa y volumen), ejercicios presión en la superficie del líquido, conocida como presión de vapor. No depende de la cantidad de líquido, sino de la temperatura, porque cuanto más alta es la temperatura, más fácilmente se separan las moléculas de la fase líquida.
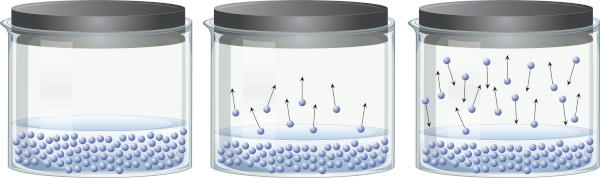
Los líquidos que tienen una alta presión de vapor a temperaturas ordinarias se llaman volátiles. Por ejemplo, a 25 °C, el éter etílico tiene una presión de vapor de 0,58 atm, la acetona (propanona) tiene una presión de vapor de 0,29 atm, mientras que el agua tiene una presión de vapor de 0,023 atm. Por cierto, cuando la presión de vapor es idéntica a la presión atmosférica, el líquido hierve. Para obtener más información sobre la presión de vapor, haga clic en aquí.
Presión de vapor y sublimación
Aunque en menor medida, los sólidos también tienen presión de vapor, pero mucho menor que la de los líquidos. Por ejemplo, incluso a una temperatura de 1000 K, la presión de vapor del hierro es de solo 9,21 x 10-20 Cajero automático. Sin embargo, algunos sólidos logran sublimarse, como el yodo, presentando una mayor presión de vapor a temperaturas normales (4 x 10-4 Cajero automático).
Esto es posible solo con el paso de moléculas del estado sólido directamente al estado gaseoso. Para que esto suceda, el Las moléculas del sólido deben presentar interacciones intermoleculares débil (en yodo, por ejemplo, son del tipo dipolo inducido-dipolo inducido).
También se ve que el proceso de sublimación es endotérmico, es decir, existe la necesidad de que las moléculas del sólido absorban energía en forma de calor para que puedan romper las interacciones intermoleculares y pasar al estado de vapor. La cantidad de calor involucrada se puede medir mediante una cantidad termodinámica conocida como entalpía de sublimación.
Diagrama de fases
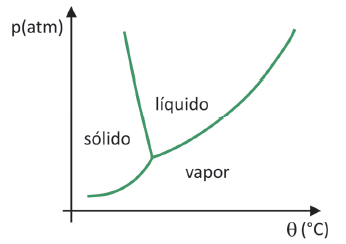
Para si saber en qué rango de presión y temperatura ocurrirá la sublimación de un sólido, necesita evaluar su diagrama de fase. Veamos el caso del dióxido de carbono, CO2.

En un diagrama de fase, las líneas límite entre estados (sólido, líquido y gas) reúnen los valores de presión y temperatura para se produce un cambio de estado. Al observar el caso del CO2, se observa que a 1 atmósfera de presión, la fase sólida pasa directamente a la fase vapor a una temperatura de -78,5 °C, lo que caracteriza una sublimación.
El dióxido de carbono solo tiene una fase líquida a presiones superiores a 5,11 atmósferas, y más allá de esa presión, la sublimación ya no es posible. Para obtener más información sobre el diagrama de fase, haga clic en aquí.
ejemplos de sublimacion
Hielo seco: el hielo seco, que a menudo se usa para crear efectos de niebla en fiestas y eventos, es en realidad dióxido de carbono en estado sólido.

bolas de naftalina: las bolas de naftalina están hechas de naftalina, un compuesto orgánico aromático. Se aplica para eliminar malos olores y también ahuyentar polillas, cucarachas y otros animales venenosos, por lo que es habitual que se utilicen en armarios o incluso en urinarios.

Alcanfor: Con un olor característico, los guijarros de alcanfor también pueden sufrir sublimación. También sirven para ahuyentar a los mosquitos y prevenir el moho.

Yodo: el no metal perteneciente a los halógenos también sufre sublimación.

Sin embargo, entre las sustancias presentadas, solo el dióxido de carbono sufre sublimación en condiciones ambientales. Los demás, incluso con sublimación, pueden sufrir una fusión normal bajo la presión en la que vivimos.
Lea también: Plasma: el cuarto estado de la materia
Ejercicios resueltos de sublimación
Pregunta 1
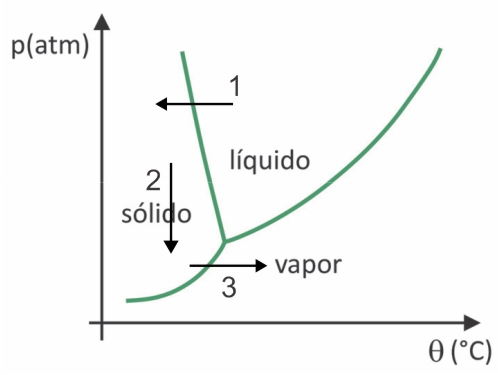
(Fuvest 2020) En los supermercados es común encontrar los llamados alimentos liofilizados, como frutas, verduras y carnes. Los alimentos liofilizados siguen siendo aptos para el consumo después de mucho tiempo, incluso sin refrigeración. El término “liofilizado” en estos alimentos se refiere al proceso de congelación y posterior deshidratación por sublimación del agua. Para que ocurra la sublimación del agua, se requiere una combinación de condiciones, como se muestra en el gráfico de presión-temperatura, donde las líneas representan las transiciones de fase.
A pesar de ser un proceso que requiere, industrialmente, el uso de cierta tecnología, existe evidencia de que los pueblos Los precolombinos que vivían en las regiones más altas de los Andes pudieron liofilizar alimentos, lo que hizo posible almacenarlos para mas tiempo. Marque la alternativa que explica cómo ocurrió el proceso de liofilización natural:
a) La sublimación del agua ocurrió debido a las bajas temperaturas y la alta presión atmosférica en las montañas.
b) Los alimentos, luego de ser congelados naturalmente en épocas frías, eran llevados a la parte más baja de las montañas, donde la presión atmosférica era menor, lo que hacía posible la sublimación.
c) El alimento se expuso al sol para aumentar la temperatura, y la baja presión atmosférica local favoreció la solidificación.
d) Las temperaturas eran lo suficientemente bajas en los períodos fríos para congelar los alimentos, y la baja presión atmosférica en las altas montañas hizo posible la sublimación.
e) Los alimentos, luego de ser congelados naturalmente, se prensaban para aumentar la presión, de manera que pudiera ocurrir la sublimación.
Respuesta: letra D.
En la liofilización, se produce la congelación del agua con su sublimación posterior. Los pueblos precolombinos podían llevar a cabo tal proceso, ya que en invierno el agua podía congelarse (flecha 1) y, con las bajas presiones (flecha 2) de las regiones más altas de los Andes, podría sufrir sublimación (flecha 3).
Pregunta 2
(Uerj 2005) El hielo seco, o dióxido de carbono solidificado, ampliamente utilizado en procesos de refrigeración, sufre sublimación en condiciones ambientales. Durante esta transformación, ocurren los fenómenos de variación de energía y disrupción de interacciones, entre otros.
Estos fenómenos se clasifican, respectivamente, como:
a) exotérmico - interiónico
b) exotérmico - internuclear
c) isotérmico - interatómico
d) endotérmico - intermolecular
Respuesta: letra D.
La sublimación es un proceso endotérmico, ya que requiere la absorción de calor para interrumpir las interacciones que mantienen compactas las moléculas de la fase sólida. Estas interacciones son de tipo intermolecular.
Por Stefano Araújo Novais
Profesor de química
Conozca más profundamente sobre este fenómeno.
La respuesta está en los cambios de presión y temperatura.
Aprenda sobre los estados físicos de la materia y vea cuáles son. Aprende también qué es Bose-Einstein y dónde podemos encontrar materia en estado de plasma.
Las fuerzas de dipolo inducido-dipolo inducido son las fuerzas intermoleculares más débiles que se producen entre moléculas no polares.
Vea cómo identificar si una sustancia tiene un punto de ebullición más alto que otra por la relación entre las fuerzas intermoleculares y el punto de ebullición.


