LA entalpía (H) se puede definir como el contenido energético de cada material o como la energía total de un sistema. Sin embargo, en la práctica no es posible determinar la entalpía de una sustancia. Entonces, lo que generalmente se mide es el variación de entalpía 

Analizaremos aquí la variación de entalpía en reacciones exotérmicas (la palabra “exo” viene del griego y significa “fuera, fuera, fuera”), que son aquellas reacciones en las que hay liberación de calor. En la vida cotidiana, hay muchos ejemplos de estas reacciones, como la combustión y la mezcla de cal viva con agua.
En estos casos, la variación de entalpía 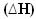 será exactamente la cantidad de calor liberada, dada por el valor de la entalpía final menos la entalpía inicial (HF - HI) o, como es una reacción, el valor de entalpía de los productos menos el de los reactivos (HPAG - HR).
será exactamente la cantidad de calor liberada, dada por el valor de la entalpía final menos la entalpía inicial (HF - HI) o, como es una reacción, el valor de entalpía de los productos menos el de los reactivos (HPAG - HR).
A medida que se libera calor, se pierde energía. Así, la energía total del sistema disminuye, por lo que la entalpía de los productos siempre será menor que la de los reactivos, por lo que la variación de entalpía en reacciones exotérmicas siempre será negativa, menor que cero
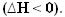
Considerando una reacción exotérmica genérica:
| A → B + calor |
Esto se puede expresar mediante un diagrama de entalpía, como el siguiente:
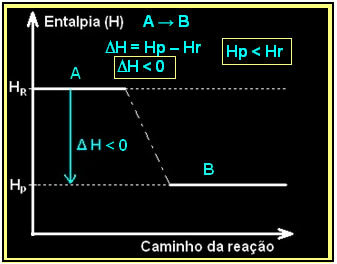
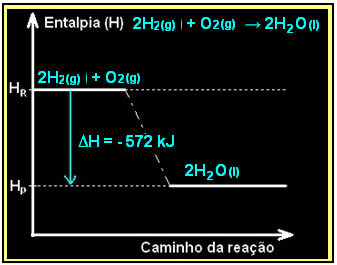
La combustión del gas hidrógeno, con la formación de agua líquida, se produce con la liberación de energía. El valor de la variación de entalpía del sistema en esta reacción viene dado por:
2 h2 (g) + O2 (g) → 2H2O(1)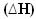 = - 572 kJ
= - 572 kJ
Su diagrama se representaría de la siguiente manera:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm

