Como se explica en el texto "Catálisis y catalizador”, Los catalizadores son especies químicas que aceleran la velocidad de las reacciones. Su uso es de gran utilidad en industrias químicas, donde se busca ahorrar el mayor tiempo posible en la producción.
Sin embargo, en determinadas situaciones es más interesante que la reacción avance más lentamente; como, por ejemplo, cuando se quiere determinar la velocidad de reacciones muy rápidas. Para lograr esta hazaña, controlando y estudiando estas reacciones, se acostumbra agregar una sustancia que ralentiza las reacciones, que se denominan inhibidores, venenos o anticatalizadores.
Estas especies químicas se combinan con el catalizador, anulando o disminuyendo su acción. Esto es posible porque el mecanismo de acción del catalizador es disminuir la energía de activación, facilitando el proceso de reacción y aumentando su velocidad; ya los inhibidores actúan a la inversa, lo que significa que aumentan la energía de activación necesaria para que los reactivos alcancen el complejo activado.
Un ejemplo que se puede mencionar es el arsénico (As), que tiene esta función en la reacción de Haber-Bosch, reacción muy utilizada en la industria para la producción de amoniaco, utilizando hierro (Fe(s)) como su catalizador. Así, la eficiencia del hierro se vuelve muy pequeña en presencia de arsénico, que lo inhibe, es decir, es el veneno catalizador de esta reacción, que se muestra a continuación:
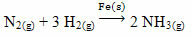
El arsénico también puede ejercer una acción anti-catalítica cuando se usa platino metálico (Pt(s)) como catalizador para la reacción de combustión de SO2 (g), para la producción de trióxido de azufre (SO3 (g)). La presencia de arsénico, incluso en pequeñas cantidades, anula la acción catalítica del platino, que puede paralizar parte de la producción. Por eso, normalmente, en las industrias que se ocupan de esta producción, se utiliza pentóxido de divanadio (V2O5 (s)) como catalizador en lugar de platino.
Otro ejemplo ocurre en la siguiente reacción de descomposición del peróxido de hidrógeno:
2 horas2O2 (aq) → 2 H2O(1) + 1 O2 (g)
En este caso, un inhibidor que se puede usar es algo de ácido, porque cuando el medio es ácido, la reacción avanza más lentamente.
Pero el inhibidor también es ampliamente utilizado por la industria, principalmente para actuar como retardador de la reacción de la degradación natural de alimentos, bebidas, cosméticos y medicamentos.
Los cosméticos, por ejemplo, pueden tardar mucho en llegar al consumidor; así, en ellos se utilizan diversos conservantes, como el propilparabeno, que se utiliza en fase oleosa y actúa como antifúngico, y el metilparabeno, que se utiliza en fase acuosa y que tiene efecto antiséptico. Sus respectivas estructuras se muestran a continuación:
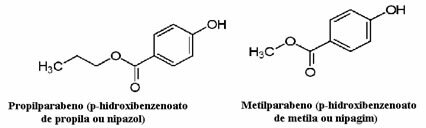
Es interesante que en muchas etiquetas de cosméticos aparezca la siguiente frase: “No contiene parabenos”. Esto quiere decir que este cosmético no tiene estos conservantes que mencionamos y que, normalmente, no han sido testados en animales.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm
